

La force de retrait de n'importe quelle unité de longueur à la surface du liquide s'appelle la tension superficielle, et l'unité est N.·m-1.

La propriété de réduire la tension superficielle du solvant est appelée activité de surface, et une substance possédant cette propriété est appelée substance tensioactive.
La substance tensioactive qui peut lier des molécules en solution aqueuse et former des micelles et d'autres associations, et avoir une activité de surface élevée, tout en ayant également un effet mouillant, émulsifiant, moussant, lavant, etc. est appelée tensioactif.
Les tensioactifs sont des composés organiques avec une structure et des propriétés spéciales, qui peuvent modifier de manière significative la tension interfaciale entre deux phases ou la tension superficielle des liquides (généralement de l'eau), avec des propriétés mouillantes, moussantes, émulsifiantes, lavantes et autres.
En termes de structure, les tensioactifs ont pour caractéristique commune de contenir deux groupes de nature différente dans leurs molécules.À une extrémité se trouve une longue chaîne de groupe non polaire, soluble dans l'huile et insoluble dans l'eau, également appelé groupe hydrophobe ou groupe hydrofuge.Un tel groupe hydrofuge est généralement de longues chaînes d'hydrocarbures, parfois aussi pour le fluor organique, le silicium, l'organophosphate, la chaîne organostannique, etc. À l'autre extrémité se trouve un groupe hydrosoluble, un groupe hydrophile ou un groupe oléofuge.Le groupe hydrophile doit être suffisamment hydrophile pour garantir que les tensioactifs entiers sont solubles dans l'eau et ont la solubilité nécessaire.Comme les tensioactifs contiennent des groupes hydrophiles et hydrophobes, ils peuvent être solubles dans au moins une des phases liquides.Cette propriété hydrophile et lipophile du tensioactif est appelée amphiphilie.


Le surfactant est une sorte de molécules amphiphiles avec des groupes hydrophobes et hydrophiles.Les groupes hydrophobes des tensioactifs sont généralement composés d'hydrocarbures à longue chaîne, tels que l'alkyle à chaîne droite C8 ~ C20, l'alkyle à chaîne ramifiée C8 ~ C20, l'alkylphényle (le nombre de tom de carbone alkyle est de 8 ~ 16) et similaires.La différence qui est faible entre les groupes hydrophobes réside principalement dans les changements structurels des chaînes d'hydrocarbures.Et les types de groupes hydrophiles sont plus nombreux, de sorte que les propriétés des tensioactifs sont principalement liées aux groupes hydrophiles en plus de la taille et de la forme des groupes hydrophobes.Les changements structurels des groupes hydrophiles sont plus importants que ceux des groupes hydrophobes, de sorte que la classification des tensioactifs est généralement basée sur la structure des groupes hydrophiles.Cette classification est basée sur le fait que le groupe hydrophile est ionique ou non, et elle est divisée en tensioactifs anioniques, cationiques, non ioniques, zwitterioniques et autres types spéciaux de tensioactifs.

① Adsorption des tensioactifs à l'interface
Les molécules tensioactives sont des molécules amphiphiles ayant à la fois des groupes lipophiles et hydrophiles.Lorsque le tensioactif est dissous dans l'eau, son groupe hydrophile est attiré par l'eau et se dissout dans l'eau, tandis que son groupe lipophile est repoussé par l'eau et quitte l'eau, entraînant l'adsorption de molécules de tensioactif (ou ions) à l'interface des deux phases , ce qui réduit la tension interfaciale entre les deux phases.Plus les molécules de surfactant (ou ions) sont adsorbées à l'interface, plus la réduction de la tension interfaciale est importante.
② Certaines propriétés de la membrane d'adsorption
Pression de surface de la membrane d'adsorption : adsorption de surfactant à l'interface gaz-liquide pour former une membrane d'adsorption, telle que placer une feuille flottante amovible sans frottement sur l'interface, la feuille flottante pousse la membrane adsorbante le long de la surface de la solution et la membrane génère une pression sur la feuille flottante, appelée pression de surface.
Viscosité de surface : Comme la pression de surface, la viscosité de surface est une propriété présentée par la membrane moléculaire insoluble.Suspendu par un anneau de platine en fil métallique fin, de sorte que son plan entre en contact avec la surface de l'eau du réservoir, faites tourner l'anneau de platine, l'anneau de platine par la viscosité de l'obstacle à l'eau, l'amplitude diminue progressivement, selon laquelle la viscosité de surface peut être mesuré.La méthode est la suivante : premièrement, l'expérience est menée sur la surface de l'eau pure pour mesurer la décroissance de l'amplitude, puis la décroissance après la formation de la membrane de surface est mesurée, et la viscosité de la membrane de surface est dérivée de la différence entre les deux .
La viscosité de surface est étroitement liée à la solidité de la membrane de surface, et puisque la membrane d'adsorption a une pression et une viscosité de surface, elle doit avoir une élasticité.Plus la pression de surface est élevée et plus la viscosité de la membrane adsorbée est élevée, plus son module d'élasticité est élevé.Le module d'élasticité de la membrane d'adsorption de surface est important dans le processus de stabilisation des bulles.
③ Formation de micelles
Les solutions diluées de tensioactifs obéissent aux lois suivies par les solutions idéales.La quantité de tensioactif adsorbé à la surface de la solution augmente avec la concentration de la solution, et lorsque la concentration atteint ou dépasse une certaine valeur, la quantité d'adsorption n'augmente plus, et ces molécules de tensioactif en excès se retrouvent dans la solution de manière aléatoire. manière ou d'une manière régulière.La pratique et la théorie montrent qu'elles forment des associations en solution, et ces associations sont appelées micelles.
Concentration micellaire critique (CMC) : la concentration minimale à laquelle les tensioactifs forment des micelles en solution est appelée concentration micellaire critique.
④ Valeurs CMC des tensioactifs courants.

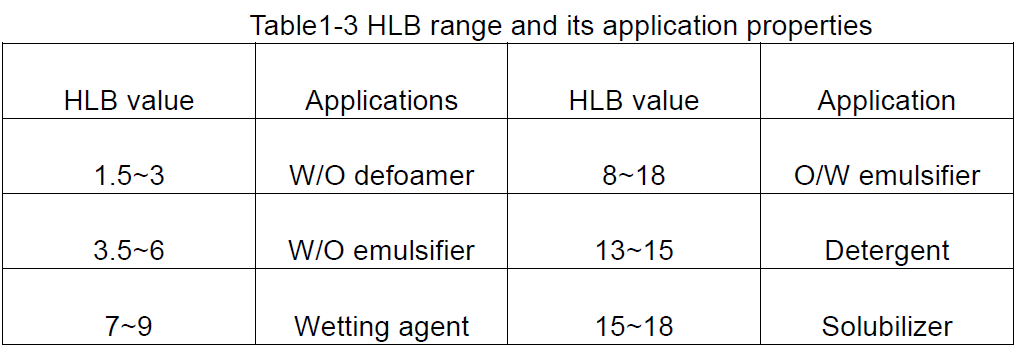
HLB est l'abréviation de balance hydrophile lipophile, qui indique la balance hydrophile et lipophile des groupes hydrophiles et lipophiles du tensioactif, c'est-à-dire la valeur HLB du tensioactif.Une grande valeur HLB indique une molécule avec une forte hydrophilie et une faible lipophilie ;à l'inverse, une forte lipophilie et une faible hydrophilie.
① Dispositions de la valeur HLB
La valeur HLB est une valeur relative, donc lorsque la valeur HLB est développée, en tant que norme, la valeur HLB de la cire de paraffine, qui n'a pas de propriétés hydrophiles, est spécifiée comme étant de 0, tandis que la valeur HLB du dodécylsulfate de sodium, qui est plus soluble dans l'eau, est de 40. Par conséquent, la valeur HLB des tensioactifs est généralement comprise entre 1 et 40. De manière générale, les émulsifiants avec des valeurs HLB inférieures à 10 sont lipophiles, tandis que ceux supérieurs à 10 sont hydrophiles.Ainsi, le point de retournement de lipophile à hydrophile est d'environ 10.
Sur la base des valeurs HLB des tensioactifs, une idée générale de leurs utilisations possibles peut être obtenue, comme indiqué dans le tableau 1-3.

Deux liquides mutuellement insolubles, l'un dispersé dans l'autre sous forme de particules (gouttelettes ou cristaux liquides) forment un système appelé émulsion.Ce système est thermodynamiquement instable en raison de l'augmentation de la surface limite des deux liquides lors de la formation de l'émulsion.Afin de rendre l'émulsion stable, il est nécessaire d'ajouter un troisième composant - émulsifiant pour réduire l'énergie interfaciale du système.L'émulsifiant appartient au tensioactif, sa fonction principale est de jouer le rôle d'émulsion.La phase de l'émulsion qui existe sous forme de gouttelettes est appelée phase dispersée (ou phase interne, phase discontinue), et l'autre phase qui est liée ensemble est appelée milieu de dispersion (ou phase externe, phase continue).
① Émulsifiants et émulsions
Émulsions courantes, une phase est de l'eau ou une solution aqueuse, l'autre phase est constituée de substances organiques non miscibles à l'eau, telles que la graisse, la cire, etc. L'émulsion formée par l'eau et l'huile peut être divisée en deux types en fonction de leur situation de dispersion : huile dispersée dans l'eau pour former une émulsion de type huile dans l'eau, exprimée en H/E (huile/eau) : eau dispersée dans l'huile pour former une émulsion de type huile dans l'eau, exprimée en E/H (eau/huile).Des multi-émulsions complexes de type eau-dans-huile-dans-eau de type E/H et huile-dans-eau-dans-huile H/E/H peuvent également être formées.
Les émulsifiants sont utilisés pour stabiliser les émulsions en réduisant la tension interfaciale et en formant une membrane interfaciale à molécule unique.
Dans l'émulsification des exigences de l'émulsifiant :
a : L'émulsifiant doit être capable d'adsorber ou d'enrichir l'interface entre les deux phases, de sorte que la tension interfaciale soit réduite ;
b: L'émulsifiant doit donner les particules à la charge, de sorte que la répulsion électrostatique entre les particules, ou forme une membrane protectrice stable et très visqueuse autour des particules.
Par conséquent, la substance utilisée comme émulsifiant doit avoir des groupes amphiphiles pour s'émulsifier, et les tensioactifs peuvent répondre à cette exigence.
② Méthodes de préparation des émulsions et facteurs affectant la stabilité des émulsions
Il existe deux manières de préparer des émulsions : la première consiste à utiliser la méthode mécanique pour disperser le liquide en minuscules particules dans un autre liquide, qui est principalement utilisé dans l'industrie pour préparer des émulsions ;l'autre consiste à dissoudre le liquide à l'état moléculaire dans un autre liquide, puis à le rassembler correctement pour former des émulsions.
La stabilité d'une émulsion est la capacité à l'agrégation anti-particules qui conduit à une séparation de phase.Les émulsions sont des systèmes thermodynamiquement instables avec une grande énergie libre.Par conséquent, la soi-disant stabilité d'une émulsion est en fait le temps nécessaire pour que le système atteigne l'équilibre, c'est-à-dire le temps nécessaire pour que la séparation de l'un des liquides dans le système se produise.
Lorsque la membrane interfaciale avec des alcools gras, des acides gras et des amines grasses et d'autres molécules organiques polaires, la résistance de la membrane est nettement plus élevée.En effet, dans la couche d'adsorption interfaciale des molécules d'émulsifiant et des alcools, des acides et des amines et d'autres molécules polaires pour former un "complexe", de sorte que la résistance de la membrane interfaciale a augmenté.
Les émulsifiants constitués de plus de deux tensioactifs sont appelés émulsifiants mixtes.Émulsifiant mixte adsorbé à l'interface eau/huile ;l'action intermoléculaire peut former des complexes.En raison de la forte action intermoléculaire, la tension interfaciale est considérablement réduite, la quantité d'émulsifiant adsorbé à l'interface est considérablement augmentée, la formation de la densité de la membrane interfaciale augmente, la résistance augmente.
La charge des billes liquides a un effet significatif sur la stabilité de l'émulsion.Emulsions stables, dont les billes liquides sont généralement chargées.Lorsqu'un émulsifiant ionique est utilisé, l'ion émulsifiant adsorbé à l'interface a son groupe lipophile inséré dans la phase huileuse et le groupe hydrophile est dans la phase aqueuse, ce qui rend les billes liquides chargées.Comme les perles d'émulsion avec la même charge, elles se repoussent, pas faciles à agglomérer, de sorte que la stabilité est augmentée.On peut voir que plus il y a d'ions émulsifiants adsorbés sur les perles, plus la charge est importante, plus la capacité d'empêcher les perles de s'agglomérer est grande, plus le système d'émulsion est stable.
La viscosité du milieu de dispersion de l'émulsion a une certaine influence sur la stabilité de l'émulsion.Généralement, plus la viscosité du milieu de dispersion est élevée, plus la stabilité de l'émulsion est élevée.En effet, la viscosité du milieu de dispersion est importante, ce qui a un effet important sur le mouvement brownien des billes liquides et ralentit la collision entre les billes liquides, de sorte que le système reste stable.Habituellement, les substances polymères qui peuvent être dissoutes dans les émulsions peuvent augmenter la viscosité du système et augmenter la stabilité des émulsions.De plus, les polymères peuvent également former une membrane interfaciale solide, rendant le système d'émulsion plus stable.
Dans certains cas, l'ajout de poudre solide peut aussi faire en sorte que l'émulsion ait tendance à se stabiliser.La poudre solide est dans l'eau, l'huile ou l'interface, selon l'huile, l'eau sur la capacité de mouillage de la poudre solide, si la poudre solide n'est pas complètement mouillée avec de l'eau, mais aussi mouillée par l'huile, restera sur l'eau et l'huile interface.
La poudre solide ne rend pas l'émulsion stable car la poudre rassemblée à l'interface améliore la membrane interfaciale, qui est similaire à l'adsorption interfaciale des molécules d'émulsifiant, de sorte que plus le matériau de poudre solide est disposé à l'interface, plus stable le l'émulsion est.
Les tensioactifs ont la capacité d'augmenter considérablement la solubilité des substances organiques insolubles ou légèrement hydrosolubles après la formation de micelles en solution aqueuse, et la solution est transparente à ce moment.Cet effet de la micelle est appelé solubilisation.Le surfactant qui peut produire la solubilisation est appelé solubilisant, et la matière organique qui est solubilisée est appelée matière solubilisée.

La mousse joue un rôle important dans le processus de lavage.La mousse est un système de dispersion dans lequel un gaz est dispersé dans un liquide ou un solide, avec le gaz comme phase dispersée et le liquide ou le solide comme milieu de dispersion, le premier étant appelé mousse liquide, tandis que le second est appelé mousse solide, par exemple comme plastique moussé, verre moussé, ciment moussé, etc.
(1) Formation de mousse
Par mousse on entend ici un agrégat de bulles d'air séparées par une membrane liquide.Ce type de bulle monte toujours rapidement à la surface du liquide en raison de la grande différence de densité entre la phase dispersée (gaz) et le milieu de dispersion (liquide), combinée à la faible viscosité du liquide.
Le processus de formation d'une bulle consiste à amener une grande quantité de gaz dans le liquide, et les bulles dans le liquide reviennent rapidement à la surface, formant un agrégat de bulles séparées par une petite quantité de gaz liquide.
La mousse a deux caractéristiques importantes en termes de morphologie : l'une est que les bulles en tant que phase dispersée sont souvent de forme polyédrique, c'est parce qu'à l'intersection des bulles, le film liquide a tendance à s'amincir de sorte que les bulles deviennent polyédrique, lorsque le film liquide s'amincit dans une certaine mesure, cela conduit à la rupture des bulles;la seconde est que les liquides purs ne peuvent pas former de mousse stable, le liquide qui peut former de la mousse est composé d'au moins deux composants ou plus.Les solutions aqueuses d'agents tensioactifs sont typiques des systèmes susceptibles de générer de la mousse, et leur capacité à générer de la mousse est également liée à d'autres propriétés.
Les tensioactifs à bon pouvoir moussant sont appelés agents moussants.Bien que l'agent moussant ait une bonne capacité de mousse, la mousse formée peut ne pas être capable de se maintenir longtemps, c'est-à-dire que sa stabilité n'est pas nécessairement bonne.Afin de maintenir la stabilité de la mousse, souvent dans l'agent moussant pour ajouter des substances qui peuvent augmenter la stabilité de la mousse, la substance est appelée stabilisateur de mousse, le stabilisant couramment utilisé est la lauryl diéthanolamine et l'oxyde de dodécyl diméthylamine.
(2) Stabilité de la mousse
La mousse est un système thermodynamiquement instable et la tendance finale est que la surface totale du liquide dans le système diminue après la rupture de la bulle et que l'énergie libre diminue.Le processus de démoussage est le processus par lequel la membrane liquide séparant le gaz devient plus épaisse et plus mince jusqu'à ce qu'elle se brise.Par conséquent, le degré de stabilité de la mousse est principalement déterminé par la vitesse de décharge du liquide et la résistance du film liquide.Les facteurs suivants influencent également cela.
(3) Destruction de la mousse
Le principe de base de la destruction de la mousse est de modifier les conditions qui produisent la mousse ou d'éliminer les facteurs de stabilisation de la mousse, il existe donc des méthodes physiques et chimiques de démoussage.
Le démoussage physique consiste à modifier les conditions de production de mousse tout en maintenant la composition chimique de la solution moussante, telles que les perturbations externes, les changements de température ou de pression et le traitement par ultrasons sont toutes des méthodes physiques efficaces pour éliminer la mousse.
La méthode de démoussage chimique consiste à ajouter certaines substances pour interagir avec l'agent moussant afin de réduire la résistance du film liquide dans la mousse et ainsi réduire la stabilité de la mousse pour atteindre l'objectif de démoussage, ces substances sont appelées antimousse.La plupart des agents anti-mousse sont des tensioactifs.Par conséquent, selon le mécanisme de démoussage, l'antimousse doit avoir une forte capacité à réduire la tension superficielle, facile à adsorber sur la surface, et l'interaction entre les molécules d'adsorption de surface est faible, les molécules d'adsorption disposées dans une structure plus lâche.
Il existe différents types d'agents anti-mousse, mais fondamentalement, ce sont tous des tensioactifs non ioniques.Les tensioactifs non ioniques ont des propriétés anti-mousse proches ou au-dessus de leur point de trouble et sont souvent utilisés comme anti-mousse.Les alcools, notamment les alcools à structure ramifiée, les acides gras et les esters d'acides gras, les polyamides, les esters phosphates, les huiles de silicone, etc. sont également couramment utilisés comme excellents antimousses.
(4) Mousse et lavage
Il n'y a pas de lien direct entre la mousse et l'efficacité du lavage et la quantité de mousse n'indique pas l'efficacité du lavage.Par exemple, les tensioactifs non ioniques ont beaucoup moins de propriétés moussantes que les savons, mais leur décontamination est bien meilleure que les savons.
Dans certains cas, la mousse peut être utile pour éliminer la saleté et la crasse.Par exemple, lors du lavage de la vaisselle à la maison, la mousse du détergent capte les gouttelettes d'huile et lors du frottement des tapis, la mousse aide à ramasser la poussière, la poudre et d'autres saletés solides.De plus, la mousse peut parfois être utilisée comme indicateur de l'efficacité d'un détergent.Parce que les huiles grasses ont un effet inhibiteur sur la mousse du détergent, lorsqu'il y a trop d'huile et trop peu de détergent, aucune mousse ne sera générée ou la mousse d'origine disparaîtra.La mousse peut aussi parfois être utilisée comme indicateur de la propreté d'un rinçage, car la quantité de mousse dans la solution de rinçage a tendance à diminuer avec la réduction de détergent, de sorte que la quantité de mousse peut être utilisée pour évaluer le degré de rinçage.
Au sens large, le lavage est le processus qui consiste à éliminer les composants indésirables de l'objet à laver et à atteindre un objectif.Le lavage au sens habituel fait référence au processus d'élimination de la saleté de la surface du support.Lors du lavage, l'interaction entre la saleté et le support est affaiblie ou éliminée par l'action de certaines substances chimiques (par exemple, un détergent, etc.), de sorte que la combinaison de saleté et de support est transformée en une combinaison de saleté et de détergent, et enfin la saleté est séparée du support.Comme les objets à laver et la saleté à enlever sont divers, le lavage est un processus très complexe et le processus de base du lavage peut être exprimé dans les relations simples suivantes.
Carrie··Saleté + Détergent= Transporteur + Saleté·Détergent
Le processus de lavage peut généralement être divisé en deux étapes : premièrement, sous l'action du détergent, la saleté est séparée de son support ;d'autre part, la saleté détachée est dispersée et mise en suspension dans le milieu.Le processus de lavage est un processus réversible et la saleté dispersée et en suspension dans le milieu peut également être reprécipitée du milieu vers l'objet à laver.Par conséquent, un bon détergent doit avoir la capacité de disperser et de suspendre la saleté et d'empêcher le redéposition de la saleté, en plus de la capacité d'éliminer la saleté du support.
(1) Types de salissures
Même pour un même article, le type, la composition et la quantité de saleté peuvent varier en fonction de l'environnement dans lequel il est utilisé.La saleté du corps huileux est principalement constituée d'huiles animales et végétales et d'huiles minérales (telles que le pétrole brut, le mazout, le goudron de houille, etc.), la saleté solide est principalement la suie, les cendres, la rouille, le noir de carbone, etc. En termes de saleté des vêtements, il y a de la saleté provenant du corps humain, comme de la sueur, du sébum, du sang, etc.;la saleté provenant des aliments, comme les taches de fruits, les taches d'huile de cuisson, les taches de condiments, l'amidon, etc. ;la saleté des cosmétiques, comme le rouge à lèvres, le vernis à ongles, etc. ;la saleté de l'atmosphère, telle que la suie, la poussière, la boue, etc. ;d'autres, comme l'encre, le thé, le revêtement, etc. Il en existe de différents types.
Les différents types de salissures peuvent généralement être divisés en trois grandes catégories : les salissures solides, les salissures liquides et les salissures spéciales.
① Saleté solide
La saleté solide courante comprend des particules de cendre, de boue, de terre, de rouille et de noir de carbone.La plupart de ces particules ont une charge électrique à leur surface, la plupart d'entre elles sont chargées négativement et peuvent être facilement adsorbées sur des articles en fibres.La saleté solide est généralement difficile à dissoudre dans l'eau, mais peut être dispersée et mise en suspension par des solutions détergentes.La saleté solide avec un point de masse plus petit est plus difficile à éliminer.
② Saleté liquide
La saleté liquide est principalement soluble dans l'huile, y compris les huiles végétales et animales, les acides gras, les alcools gras, les huiles minérales et leurs oxydes.Parmi eux, les huiles végétales et animales, les acides gras et la saponification alcaline peuvent se produire, tandis que les alcools gras, les huiles minérales ne sont pas saponifiées par les alcalis, mais peuvent être solubles dans les alcools, les éthers et les solvants organiques hydrocarbonés, et l'émulsification et la dispersion des solutions aqueuses détergentes.La saleté liquide soluble dans l'huile a généralement une forte force avec les articles en fibres et est plus fermement adsorbée sur les fibres.
③ Saleté spéciale
La saleté spéciale comprend les protéines, l'amidon, le sang, les sécrétions humaines telles que la sueur, le sébum, l'urine et les jus de fruits et le jus de thé.La plupart de ce type de saleté peut être chimiquement et fortement adsorbée sur les articles en fibres.Par conséquent, il est difficile à laver.
Les différents types de salissures se retrouvent rarement seuls, mais sont souvent mélangés et adsorbés sur l'objet.La saleté peut parfois être oxydée, décomposée ou pourrie sous des influences extérieures, créant ainsi de nouvelles saletés.
(2)Adhérence de la saleté
Les vêtements, les mains, etc. peuvent être tachés car il y a une sorte d'interaction entre l'objet et la saleté.La saleté adhère aux objets de diverses manières, mais il n'y a rien de plus que des adhérences physiques et chimiques.
①L'adhérence de la suie, de la poussière, de la boue, du sable et du charbon de bois aux vêtements est une adhérence physique.D'une manière générale, grâce à cette adhérence de la saleté, et le rôle entre l'objet taché est relativement faible, l'élimination de la saleté est également relativement facile.Selon les différentes forces, l'adhérence physique de la saleté peut être divisée en adhérence mécanique et adhérence électrostatique.
A : Adhérence mécanique
Ce type d'adhérence fait principalement référence à l'adhérence de certaines saletés solides (par exemple, la poussière, la boue et le sable).L'adhérence mécanique est l'une des formes les plus faibles d'adhérence de la saleté et peut être éliminée presque par des moyens purement mécaniques, mais lorsque la saleté est petite (<0,1 um), elle est plus difficile à éliminer.
B:Adhésion électrostatique
L'adhérence électrostatique se manifeste principalement par l'action de particules de saleté chargées sur des objets chargés de manière opposée.La plupart des objets fibreux sont chargés négativement dans l'eau et peuvent facilement adhérer à certaines saletés chargées positivement, telles que les types de chaux.Certaines saletés, bien que chargées négativement, telles que les particules de noir de carbone dans les solutions aqueuses, peuvent adhérer aux fibres par le biais de ponts ioniques (ions entre plusieurs objets chargés de manière opposée, agissant avec eux à la manière d'un pont) formés par des ions positifs dans l'eau (par exemple , Ca2+, Mg2+ etc.).
L'action électrostatique est plus forte que la simple action mécanique, ce qui rend l'élimination de la saleté relativement difficile.
② Adhérence chimique
L'adhésion chimique fait référence au phénomène de la saleté agissant sur un objet par l'intermédiaire de liaisons chimiques ou hydrogène.Par exemple, la saleté solide polaire, les protéines, la rouille et d'autres adhérences sur les articles en fibres, les fibres contiennent des groupes carboxyle, hydroxyle, amide et autres, ces groupes et les acides gras de saleté huileuse, les alcools gras sont faciles à former des liaisons hydrogène.Les forces chimiques sont généralement fortes et la saleté est donc plus solidement liée à l'objet.Ce type de saleté est difficile à éliminer par les méthodes habituelles et nécessite des méthodes spéciales pour y faire face.
Le degré d'adhérence de la saleté est lié à la nature de la saleté elle-même et à la nature de l'objet auquel elle adhère.Généralement, les particules adhèrent facilement aux articles fibreux.Plus la texture de la saleté solide est petite, plus l'adhérence est forte.La saleté polaire sur les objets hydrophiles tels que le coton et le verre adhère plus fortement que la saleté non polaire.La saleté non polaire adhère plus fortement que la saleté polaire, comme les graisses polaires, la poussière et l'argile, et est moins facile à enlever et à nettoyer.
(3) Mécanisme d'élimination de la saleté
Le but du lavage est d'enlever la saleté.Dans un milieu d'une certaine température (principalement de l'eau).Utiliser les divers effets physiques et chimiques du détergent pour affaiblir ou éliminer l'effet de la saleté et des objets lavés, sous l'action de certaines forces mécaniques (comme le frottement des mains, l'agitation de la machine à laver, l'impact de l'eau), de sorte que la saleté et les objets lavés du but de la décontamination.
① Mécanisme d'élimination de la saleté liquide
A:Mouillage
Les salissures liquides sont principalement à base d'huile.Les taches d'huile mouillent la plupart des articles fibreux et s'étendent plus ou moins sous la forme d'un film d'huile à la surface du matériau fibreux.La première étape de l'action de lavage est le mouillage de la surface par le liquide de lavage.A titre d'illustration, la surface d'une fibre peut être considérée comme une surface solide lisse.
B : Détachement d'huile - mécanisme de bouclage
La deuxième étape de l'action de lavage est l'élimination de l'huile et de la graisse, l'élimination de la saleté liquide est réalisée par une sorte d'enroulement.La saleté liquide existait à l'origine sur la surface sous la forme d'un film d'huile étalé, et sous l'effet de mouillage préférentiel du liquide de lavage sur la surface solide (c'est-à-dire la surface de la fibre), elle s'est enroulée en perles d'huile étape par étape, qui ont été remplacés par le liquide de lavage et ont finalement quitté la surface sous certaines forces externes.
② Mécanisme d'élimination de la saleté solide
L'élimination de la saleté liquide se fait principalement par le mouillage préférentiel du support de saleté par la solution de lavage, tandis que le mécanisme d'élimination de la saleté solide est différent, où le processus de lavage concerne principalement le mouillage de la masse de saleté et de sa surface de support par le lavage. la solution.En raison de l'adsorption des tensioactifs sur la saleté solide et sa surface de support, l'interaction entre la saleté et la surface est réduite et la force d'adhérence de la masse de saleté sur la surface est réduite, ainsi la masse de saleté est facilement éliminée de la surface de le transporteur.
De plus, l'adsorption de tensioactifs, en particulier de tensioactifs ioniques, à la surface de la saleté solide et de son support a le potentiel d'augmenter le potentiel de surface à la surface de la saleté solide et de son support, ce qui est plus propice à l'élimination de la saleté.Les surfaces solides ou généralement fibreuses sont généralement chargées négativement dans les milieux aqueux et peuvent donc former des doubles couches électroniques diffuses sur des masses de saleté ou des surfaces solides.En raison de la répulsion des charges homogènes, l'adhérence des particules de saleté dans l'eau à la surface solide est affaiblie.Lorsqu'un tensioactif anionique est ajouté, car il peut simultanément augmenter le potentiel de surface négatif de la particule de saleté et de la surface solide, la répulsion entre eux est plus améliorée, la force d'adhérence de la particule est plus réduite et la saleté est plus facile à enlever .
Les tensioactifs non ioniques sont adsorbés sur des surfaces solides généralement chargées et bien qu'ils ne modifient pas de manière significative le potentiel d'interface, les tensioactifs non ioniques adsorbés ont tendance à former une certaine épaisseur de couche adsorbée sur la surface, ce qui aide à empêcher le redéposition de la saleté.
Dans le cas des tensioactifs cationiques, leur adsorption réduit ou supprime le potentiel de surface négatif de la masse de salissures et de sa surface porteuse, ce qui réduit la répulsion entre la salissure et la surface et n'est donc pas propice à l'élimination des salissures ;de plus, après adsorption sur la surface solide, les tensioactifs cationiques ont tendance à rendre la surface solide hydrophobe et ne sont donc pas propices au mouillage de la surface et donc au lavage.
③ Élimination des sols spéciaux
Les protéines, l'amidon, les sécrétions humaines, les jus de fruits, le jus de thé et autres saletés sont difficiles à éliminer avec des tensioactifs normaux et nécessitent un traitement spécial.
Les taches de protéines telles que la crème, les œufs, le sang, le lait et les excréments de la peau ont tendance à coaguler sur les fibres et à se dégénérer et à obtenir une adhérence plus forte.Les salissures protéiques peuvent être éliminées en utilisant des protéases.L'enzyme protéase décompose les protéines de la saleté en acides aminés ou oligopeptides solubles dans l'eau.
Les taches d'amidon proviennent principalement des denrées alimentaires, d'autres comme la sauce, la colle, etc. L'amylase a un effet catalytique sur l'hydrolyse des taches d'amidon, provoquant la décomposition de l'amidon en sucres.
La lipase catalyse la décomposition des triglycérides, qui sont difficiles à éliminer par les méthodes normales, telles que le sébum et les huiles comestibles, et les décompose en glycérol soluble et en acides gras.
Certaines taches colorées de jus de fruits, de jus de thé, d'encre, de rouge à lèvres, etc. sont souvent difficiles à nettoyer à fond même après plusieurs lavages.Ces taches peuvent être éliminées par une réaction redox avec un agent oxydant ou réducteur tel que l'eau de Javel, qui détruit la structure des groupes générateurs de couleur ou auxiliaires de couleur et les dégrade en composants solubles dans l'eau plus petits.
(4) Mécanisme d'élimination des taches du nettoyage à sec
Ce qui précède est en fait pour l'eau comme moyen de lavage.En fait, en raison des différents types de vêtements et de structure, certains vêtements utilisant le lavage à l'eau ne sont pas pratiques ou faciles à laver, certains vêtements après lavage et même déformation, décoloration, etc., par exemple : la plupart des fibres naturelles absorbent l'eau et facile à gonfler, sec et facile à rétrécir, donc après le lavage, il sera déformé;en lavant les produits en laine apparaissent également souvent un phénomène de rétrécissement, certains produits en laine avec lavage à l'eau sont également faciles à boulocher, à changer de couleur;Certaines sensations de main en soie s'aggravent après le lavage et perdent leur éclat.Pour ces vêtements, utilisez souvent la méthode du nettoyage à sec pour les décontaminer.Le nettoyage dit à sec désigne généralement la méthode de lavage dans des solvants organiques, en particulier dans des solvants non polaires.
Le nettoyage à sec est une forme de lavage plus douce que le lavage à l'eau.Parce que le nettoyage à sec ne nécessite pas beaucoup d'action mécanique, il n'endommage pas, ne froisse pas et ne déforme pas les vêtements, tandis que les agents de nettoyage à sec, contrairement à l'eau, produisent rarement de l'expansion et de la contraction.Tant que la technologie est correctement manipulée, les vêtements peuvent être nettoyés à sec sans distorsion, décoloration et durée de vie prolongée.
En termes de nettoyage à sec, il existe trois grands types de saleté.
①Saleté soluble dans l'huile La saleté soluble dans l'huile comprend toutes sortes d'huiles et de graisses, qui sont liquides ou grasses et peuvent être dissoutes dans des solvants de nettoyage à sec.
②Saleté soluble dans l'eau La saleté soluble dans l'eau est soluble dans les solutions aqueuses, mais pas dans les agents de nettoyage à sec, est adsorbée sur les vêtements à l'état aqueux, l'eau s'évapore après la précipitation de solides granulaires, tels que les sels inorganiques, l'amidon, les protéines, etc.
③Saleté insoluble dans l'huile et l'eau La saleté insoluble dans l'huile et l'eau n'est ni soluble dans l'eau ni soluble dans les solvants de nettoyage à sec, tels que le noir de carbone, les silicates de divers métaux et oxydes, etc.
En raison de la nature différente des différents types de saleté, il existe différentes manières d'éliminer la saleté lors du processus de nettoyage à sec.Les salissures solubles dans l'huile, telles que les huiles animales et végétales, les huiles minérales et les graisses, sont facilement solubles dans les solvants organiques et peuvent être éliminées plus facilement lors du nettoyage à sec.L'excellente solubilité des solvants de nettoyage à sec pour huiles et graisses provient essentiellement des forces de van der Walls entre les molécules.
Pour éliminer les salissures solubles dans l'eau telles que les sels inorganiques, les sucres, les protéines et la sueur, il faut également ajouter la bonne quantité d'eau à l'agent de nettoyage à sec, sinon les salissures solubles dans l'eau sont difficiles à éliminer des vêtements.Cependant, l'eau est difficile à dissoudre dans l'agent de nettoyage à sec, donc pour augmenter la quantité d'eau, vous devez également ajouter des tensioactifs.La présence d'eau dans l'agent de nettoyage à sec peut hydrater la surface de la saleté et des vêtements, de sorte qu'il est facile d'interagir avec les groupes polaires des tensioactifs, ce qui favorise l'adsorption des tensioactifs sur la surface.De plus, lorsque les tensioactifs forment des micelles, la saleté soluble dans l'eau et l'eau peuvent être solubilisées dans les micelles.En plus d'augmenter la teneur en eau du solvant de nettoyage à sec, les tensioactifs peuvent également jouer un rôle dans la prévention de la redéposition de la saleté pour améliorer l'effet de décontamination.
La présence d'une petite quantité d'eau est nécessaire pour enlever la saleté soluble dans l'eau, mais trop d'eau peut déformer et froisser certains vêtements, c'est pourquoi la quantité d'eau dans l'agent de nettoyage à sec doit être modérée.
La saleté qui n'est ni soluble dans l'eau ni soluble dans l'huile, les particules solides comme la cendre, la boue, la terre et le noir de carbone, est généralement fixée au vêtement par des forces électrostatiques ou en combinaison avec de l'huile.Dans le nettoyage à sec, le flux de solvant, l'impact peut éliminer l'adsorption de la force électrostatique de la saleté, et l'agent de nettoyage à sec peut dissoudre l'huile, de sorte que la combinaison d'huile et de saleté et attachée aux vêtements de particules solides au sec -agent de nettoyage, agent de nettoyage à sec dans une petite quantité d'eau et de tensioactifs, de sorte que ceux des particules de saleté solides puissent être en suspension stable, en dispersion, pour empêcher leur redéposition sur les vêtements.
(5) Facteurs affectant l'action de lavage
L'adsorption directionnelle des tensioactifs à l'interface et la réduction de la tension superficielle (interfaciale) sont les principaux facteurs d'élimination des salissures liquides ou solides.Cependant, le processus de lavage est complexe et l'effet de lavage, même avec le même type de détergent, est influencé par de nombreux autres facteurs.Ces facteurs incluent la concentration du détergent, la température, la nature de la salissure, le type de fibre et la structure du tissu.
① Concentration de surfactant
Les micelles de tensioactifs en solution jouent un rôle important dans le processus de lavage.Lorsque la concentration atteint la concentration micellaire critique (CMC), l'effet de lavage augmente fortement.Par conséquent, la concentration de détergent dans le solvant doit être supérieure à la valeur CMC pour avoir un bon effet de lavage.Cependant, lorsque la concentration de tensioactif est supérieure à la valeur CMC, l'augmentation incrémentielle de l'effet de lavage n'est pas évidente et il n'est pas nécessaire d'augmenter trop la concentration de tensioactif.
Lors de l'élimination de l'huile par solubilisation, l'effet de solubilisation augmente avec l'augmentation de la concentration en tensioactif, même lorsque la concentration est supérieure à la CMC.À ce moment, il est conseillé d'utiliser le détergent de manière centralisée locale.Par exemple, s'il y a beaucoup de saleté sur les poignets et le col d'un vêtement, une couche de détergent peut être appliquée pendant le lavage pour augmenter l'effet solubilisant du tensioactif sur l'huile.
②La température a une influence très importante sur l'action de décontamination.En général, l'augmentation de la température facilite l'élimination des salissures, mais parfois une température trop élevée peut également entraîner des inconvénients.
L'augmentation de la température facilite la diffusion des salissures, la graisse solide s'émulsionne facilement à des températures supérieures à son point de fusion et les fibres augmentent de gonflement du fait de l'augmentation de la température, ce qui facilite l'élimination des salissures.Cependant, pour les tissus compacts, les micro-espaces entre les fibres se réduisent au fur et à mesure de l'expansion des fibres, ce qui est préjudiciable à l'élimination des salissures.
Les changements de température affectent également la solubilité, la valeur CMC et la taille des micelles des tensioactifs, affectant ainsi l'effet de lavage.La solubilité des tensioactifs à longues chaînes carbonées est faible à basse température et parfois la solubilité est même inférieure à la valeur CMC, de sorte que la température de lavage doit être augmentée de manière appropriée.L'effet de la température sur la valeur CMC et la taille des micelles est différent pour les tensioactifs ioniques et non ioniques.Pour les tensioactifs ioniques, une augmentation de la température augmente généralement la valeur CMC et réduit la taille des micelles, ce qui signifie que la concentration de tensioactif dans la solution de lavage doit être augmentée.Pour les tensioactifs non ioniques, une augmentation de la température entraîne une diminution de la valeur CMC et une augmentation significative du volume des micelles, il est donc clair qu'une augmentation appropriée de la température aidera le tensioactif non ionique à exercer son effet tensioactif .Cependant, la température ne doit pas dépasser son point de trouble.
En bref, la température de lavage optimale dépend de la formulation du détergent et de l'objet à laver.Certains détergents ont un bon effet détergent à température ambiante, tandis que d'autres ont une détergence très différente entre le lavage à froid et à chaud.
③ Mousse
Il est d'usage de confondre pouvoir moussant et effet lavant, estimant que les détergents à fort pouvoir moussant ont un bon effet lavant.La recherche a montré qu'il n'y a pas de relation directe entre l'effet de lavage et la quantité de mousse.Par exemple, le lavage avec des détergents peu moussants n'est pas moins efficace qu'un lavage avec des détergents très moussants.
Bien que la mousse ne soit pas directement liée au lavage, il y a des occasions où elle aide à éliminer la saleté, par exemple lors du lavage de la vaisselle à la main.Lors du récurage des tapis, la mousse peut également enlever la poussière et d'autres particules de saleté solides, la saleté des tapis représente une grande partie de la poussière, de sorte que les agents de nettoyage pour tapis doivent avoir une certaine capacité moussante.
Le pouvoir moussant est également important pour les shampooings, où la fine mousse produite par le liquide lors du shampooing ou du bain laisse les cheveux lubrifiés et confortables.
④ Variétés de fibres et propriétés physiques des textiles
Outre la structure chimique des fibres, qui affecte l'adhérence et l'élimination des salissures, l'apparence des fibres et l'organisation du fil et du tissu ont une influence sur la facilité d'élimination des salissures.
Les écailles des fibres de laine et les rubans plats incurvés des fibres de coton sont plus susceptibles d'accumuler de la saleté que les fibres lisses.Par exemple, le noir de carbone taché sur des films de cellulose (films de viscose) est facile à enlever, tandis que le noir de carbone taché sur des tissus en coton est difficile à laver.Un autre exemple est que les tissus à fibres courtes en polyester sont plus susceptibles d'accumuler des taches d'huile que les tissus à fibres longues, et les taches d'huile sur les tissus à fibres courtes sont également plus difficiles à éliminer que les taches d'huile sur les tissus à fibres longues.
Les fils étroitement torsadés et les tissus serrés, en raison du petit espace entre les fibres, peuvent résister à l'invasion de la saleté, mais cela peut également empêcher le liquide de lavage d'exclure la saleté interne, de sorte que les tissus serrés commencent à bien résister à la saleté, mais une fois tachés le lavage est aussi plus difficile.
⑤ Dureté de l'eau
La concentration de Ca2+, Mg2+ et d'autres ions métalliques dans l'eau a une grande influence sur l'effet de lavage, en particulier lorsque les tensioactifs anioniques rencontrent des ions Ca2+ et Mg2+ formant des sels de calcium et de magnésium qui sont moins solubles et réduiront sa détergence.Dans l'eau dure, même si la concentration en tensioactif est élevée, la détergence est encore bien pire qu'en distillation.Pour que le surfactant ait le meilleur effet de lavage, la concentration d'ions Ca2+ dans l'eau doit être réduite à 1 x 10-6 mol/L (CaCO3 à 0,1 mg/L) ou moins.Cela nécessite l'ajout de divers adoucissants au détergent.
Heure de publication : 25 février 2022



