Table des matières de cet article :
1. Développement des acides aminés
2. Propriétés structurelles
3. Composition chimique
4.Classement
5. Synthèse
6. Propriétés physicochimiques
7. Toxicité
8. Activité antimicrobienne
9. Propriétés rhéologiques
10. Applications dans l'industrie cosmétique
11. Applications dans les cosmétiques du quotidien
Tensioactifs acides aminés (AAS)sont une classe de tensioactifs formés en combinant des groupes hydrophobes avec un ou plusieurs acides aminés.Dans ce cas, les acides aminés peuvent être synthétiques ou dérivés d'hydrolysats de protéines ou de sources renouvelables similaires.Cet article couvre les détails de la plupart des voies de synthèse disponibles pour l'AAS et l'effet des différentes voies sur les propriétés physicochimiques des produits finaux, y compris la solubilité, la stabilité de la dispersion, la toxicité et la biodégradabilité.En tant que classe de tensioactifs de plus en plus demandée, la polyvalence des SAA en raison de leur structure variable offre un grand nombre d'opportunités commerciales.
Étant donné que les tensioactifs sont largement utilisés dans les détergents, les émulsifiants, les inhibiteurs de corrosion, la récupération tertiaire du pétrole et les produits pharmaceutiques, les chercheurs n'ont jamais cessé de prêter attention aux tensioactifs.
Les tensioactifs sont les produits chimiques les plus représentatifs qui sont consommés quotidiennement en grande quantité dans le monde et qui ont eu un impact négatif sur le milieu aquatique.Des études ont montré que l'utilisation généralisée des tensioactifs traditionnels peut avoir un impact négatif sur l'environnement.
Aujourd'hui, la non-toxicité, la biodégradabilité et la biocompatibilité sont presque aussi importantes pour les consommateurs que l'utilité et la performance des tensioactifs.
Les biosurfactants sont des surfactants durables respectueux de l'environnement qui sont naturellement synthétisés par des micro-organismes tels que des bactéries, des champignons et des levures, ou sécrétés de manière extracellulaire.Par conséquent, les biosurfactants peuvent également être préparés par conception moléculaire pour imiter les structures amphiphiles naturelles, telles que les phospholipides, les alkylglycosides et les acides aminés acylés.
Tensioactifs acides aminés (AAS)sont l'un des tensioactifs typiques, généralement produits à partir de matières premières d'origine animale ou agricole.Au cours des deux dernières décennies, les AAS ont suscité beaucoup d'intérêt de la part des scientifiques en tant que nouveaux tensioactifs, non seulement parce qu'ils peuvent être synthétisés à partir de ressources renouvelables, mais aussi parce que les AAS sont facilement dégradables et contiennent des sous-produits inoffensifs, ce qui les rend plus sûrs pour le environnement.
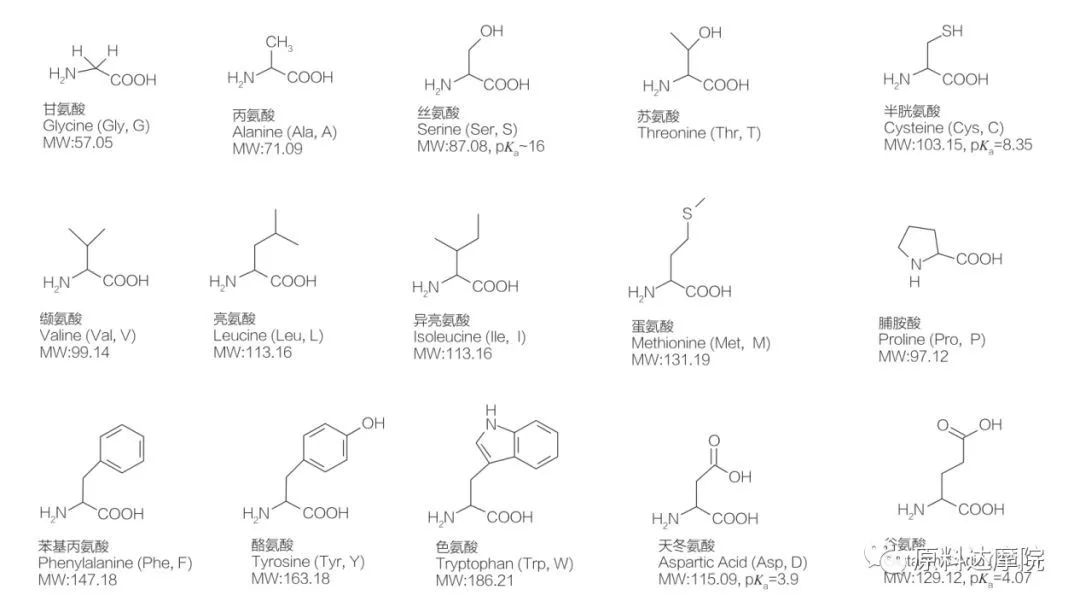
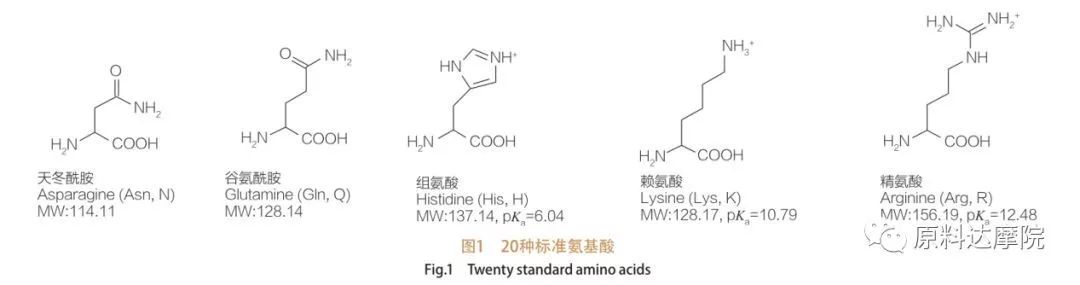
L'AAS peut être définie comme une classe de tensioactifs constituée d'acides aminés contenant des groupes d'acides aminés (HO 2 C-CHR-NH 2) ou des résidus d'acides aminés (HO 2 C-CHR-NH-).Les 2 régions fonctionnelles des acides aminés permettent la dérivation d'une grande variété de tensioactifs.Un total de 20 acides aminés protéinogènes standard sont connus pour exister dans la nature et sont responsables de toutes les réactions physiologiques dans la croissance et les activités de la vie.Ils ne diffèrent les uns des autres que par le résidu R (Figure 1, pk a est le logarithme négatif de la constante de dissociation acide de la solution).Certains sont non polaires et hydrophobes, certains sont polaires et hydrophiles, certains sont basiques et certains sont acides.
Parce que les acides aminés sont des composés renouvelables, les tensioactifs synthétisés à partir d'acides aminés ont également un fort potentiel pour devenir durables et respectueux de l'environnement.La structure simple et naturelle, la faible toxicité et la biodégradabilité rapide les rendent souvent supérieurs aux tensioactifs conventionnels.En utilisant des matières premières renouvelables (par exemple, des acides aminés et des huiles végétales), les SAA peuvent être produits par différentes voies biotechnologiques et voies chimiques.
Au début du 20e siècle, les acides aminés ont été découverts pour la première fois comme substrats pour la synthèse de tensioactifs.Les SAA étaient principalement utilisés comme conservateurs dans les formulations pharmaceutiques et cosmétiques.De plus, les SAA se sont avérées biologiquement actives contre une variété de bactéries, de tumeurs et de virus pathogènes.En 1988, la disponibilité d'AAS à faible coût a suscité un intérêt pour la recherche sur l'activité de surface.Aujourd'hui, avec le développement de la biotechnologie, certains Acides Aminés sont également capables d'être synthétisés commercialement à grande échelle par la levure, ce qui prouve indirectement que la production d'AAS est plus respectueuse de l'environnement.
01 Développement des Acides Aminés
Dès le début du 19e siècle, lorsque les acides aminés naturels ont été découverts pour la première fois, leurs structures étaient censées être extrêmement précieuses - utilisables comme matières premières pour la préparation d'amphiphiles.La première étude sur la synthèse de l'AAS a été rapportée par Bondi en 1909.
Dans cette étude, la N-acylglycine et la N-acylalanine ont été introduites en tant que groupes hydrophiles pour les tensioactifs.Des travaux ultérieurs ont impliqué la synthèse d'acides lipoaminés (AAS) à l'aide de glycine et d'alanine, et Hentrich et al.publié une série de conclusions,dont la première demande de brevet, sur l'utilisation de sels d'acyl sarcosinate et d'acyl aspartate comme tensioactifs dans des produits d'entretien ménager (par exemple, shampoings, détergents et dentifrices).Par la suite, de nombreux chercheurs ont étudié la synthèse et les propriétés physico-chimiques des acides aminés acylés.À ce jour, une abondante littérature a été publiée sur la synthèse, les propriétés, les applications industrielles et la biodégradabilité des SAA.
02 Propriétés structurelles
Les chaînes d'acides gras hydrophobes non polaires de l'AAS peuvent varier en structure, longueur de chaîne et nombre.La diversité structurelle et l'activité de surface élevée des SAA expliquent leur grande diversité de composition et leurs propriétés physico-chimiques et biologiques.Les groupes de tête de l'AAS sont composés d'acides aminés ou de peptides.Les différences dans les groupes de tête déterminent l'adsorption, l'agrégation et l'activité biologique de ces tensioactifs.Les groupes fonctionnels du groupe de tête déterminent ensuite le type d'AAS, y compris cationique, anionique, non ionique et amphotère.La combinaison d'acides aminés hydrophiles et de portions à longue chaîne hydrophobes forme une structure amphiphile qui rend la molécule hautement tensioactive.De plus, la présence d'atomes de carbone asymétriques dans la molécule aide à former des molécules chirales.
03 Composition chimique
Tous les peptides et polypeptides sont les produits de polymérisation de ces près de 20 acides alpha-aminés α-protéinogènes.Les 20 acides α-aminés contiennent tous un groupe fonctionnel acide carboxylique (-COOH) et un groupe fonctionnel amino (-NH 2), tous deux attachés au même atome de carbone α tétraédrique.Les acides aminés diffèrent les uns des autres par les différents groupes R attachés au carbone α (à l'exception de la lycine, où le groupe R est l'hydrogène.) Les groupes R peuvent différer par leur structure, leur taille et leur charge (acidité, alcalinité).Ces différences déterminent également la solubilité des acides aminés dans l'eau.
Les acides aminés sont chiraux (à l'exception de la glycine) et sont optiquement actifs par nature car ils ont quatre substituants différents liés au carbone alpha.Les acides aminés ont deux conformations possibles ;ce sont des images miroir sans chevauchement l'une de l'autre, malgré le fait que le nombre de stéréoisomères L est significativement plus élevé.Le groupe R présent dans certains acides aminés (phénylalanine, tyrosine et tryptophane) est un aryle, conduisant à une absorption UV maximale à 280 nm.L'α-COOH acide et l'α-NH 2 basique dans les acides aminés sont capables d'ionisation, et les deux stéréoisomères, quels qu'ils soient, construisent l'équilibre d'ionisation indiqué ci-dessous.
R-COOH ↔R-COO-+H+
R-NH3+↔R-NH2+H+
Comme le montre l'équilibre d'ionisation ci-dessus, les acides aminés contiennent au moins deux groupes faiblement acides ;cependant, le groupe carboxyle est beaucoup plus acide que le groupe amino protoné.pH 7,4, le groupe carboxyle est déprotoné tandis que le groupe amino est protoné.Les acides aminés avec des groupes R non ionisables sont électriquement neutres à ce pH et forment un zwitterion.
04 Classement
Le SAA peut être classé selon quatre critères, qui sont décrits ci-dessous à tour de rôle.
4.1 Selon l'origine
| Selon l'origine, l'AAS peut être divisé en 2 catégories comme suit. ① Catégorie naturelle Certains composés naturels contenant des acides aminés ont également la capacité de réduire la tension de surface/interface, et certains dépassent même l'efficacité des glycolipides.Ces AAS sont également connus sous le nom de lipopeptides.Les lipopeptides sont des composés de faible poids moléculaire, généralement produits par des espèces de Bacillus.
Ces AAS sont en outre divisés en 3 sous-classes :surfactine, iturine et fengycine.
|
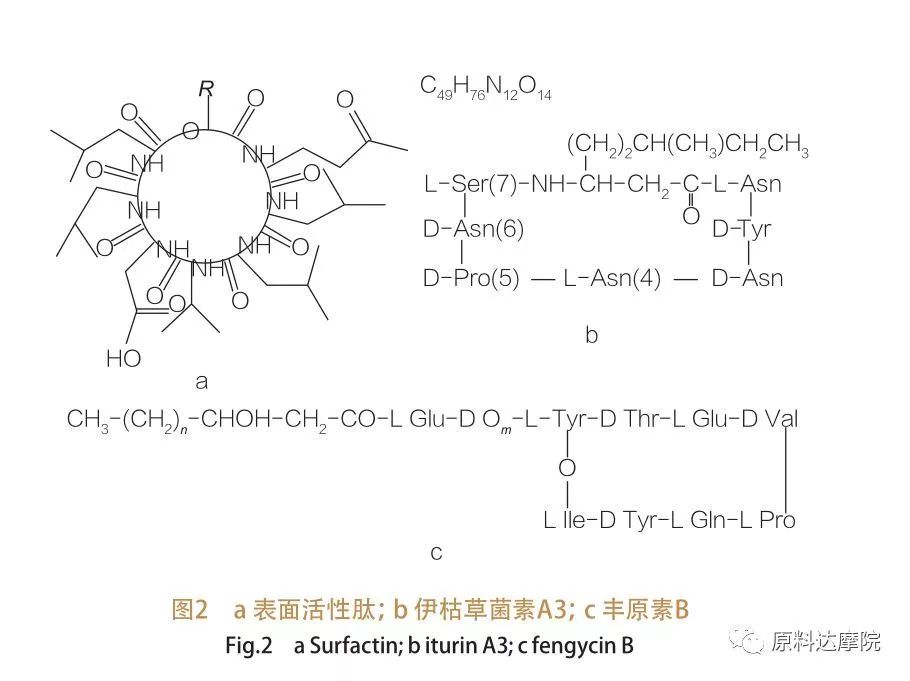
| La famille des peptides tensioactifs englobe les variants heptapeptidiques d'une variété de substances,comme le montre la figure 2a, dans laquelle une chaîne d'acides gras β-hydroxy insaturés en C12-C16 est liée au peptide.Le peptide tensioactif est une lactone macrocyclique dont le cycle est fermé par catalyse entre l'extrémité C-terminale de l'acide gras β-hydroxylé et le peptide. Dans la sous-classe de l'iturine, il existe six variantes principales, à savoir l'iturine A et C, la mycosubtiline et la bacillomycine D, F et L.Dans tous les cas, les heptapeptides sont liés aux chaînes C14-C17 des acides gras β-aminés (les chaînes peuvent être diverses).Dans le cas des ekurimycines, le groupe amino en position β peut former une liaison amide avec l'extrémité C-terminale formant ainsi une structure lactame macrocyclique.
La sous-classe fengycine contient la fengycine A et B, qui sont également appelées plipastatine lorsque Tyr9 est en configuration D.Le décapeptide est lié à une chaîne d'acide gras β-hydroxy saturé ou insaturé en C14-C18.Structurellement, la plipastatine est également une lactone macrocyclique, contenant une chaîne latérale Tyr en position 3 de la séquence peptidique et formant une liaison ester avec le résidu C-terminal, formant ainsi une structure cyclique interne (comme c'est le cas pour de nombreux lipopeptides de Pseudomonas).
② Catégorie synthétique L'AAS peut également être synthétisé en utilisant l'un des acides aminés acides, basiques et neutres.Les acides aminés couramment utilisés pour la synthèse de l'AAS sont l'acide glutamique, la sérine, la proline, l'acide aspartique, la glycine, l'arginine, l'alanine, la leucine et les hydrolysats de protéines.Cette sous-classe de tensioactifs peut être préparée par des méthodes chimiques, enzymatiques et chimioenzymatiques ;cependant, pour la production d'AAS, la synthèse chimique est plus économiquement faisable.Des exemples courants comprennent l'acide N-lauroyl-L-glutamique et l'acide N-palmitoyl-L-glutamique.
|
4.2 Basé sur les substituants de la chaîne aliphatique
Sur la base des substituants de la chaîne aliphatique, les tensioactifs à base d'acides aminés peuvent être divisés en 2 types.
Selon la position du substituant
| ①AAS N-substitué Dans les composés N-substitués, un groupe amino est remplacé par un groupe lipophile ou un groupe carboxyle, ce qui entraîne une perte de basicité.l'exemple le plus simple d'AAS N-substitué sont les acides aminés N-acylés, qui sont essentiellement des tensioactifs anioniques.Les AAS n-substitués ont une liaison amide attachée entre les parties hydrophobe et hydrophile.La liaison amide a la capacité de former une liaison hydrogène, ce qui facilite la dégradation de ce tensioactif en milieu acide, le rendant ainsi biodégradable.
②AAS substitué par C Dans les composés C-substitués, la substitution se produit au niveau du groupe carboxyle (via une liaison amide ou ester).Les composés C-substitués typiques (par exemple les esters ou les amides) sont essentiellement des tensioactifs cationiques.
③AAS N- et C-substitué Dans ce type de tensioactif, les groupes amino et carboxyle constituent la partie hydrophile.Ce type est essentiellement un tensioactif amphotère. |
4.3 Selon le nombre de queues hydrophobes
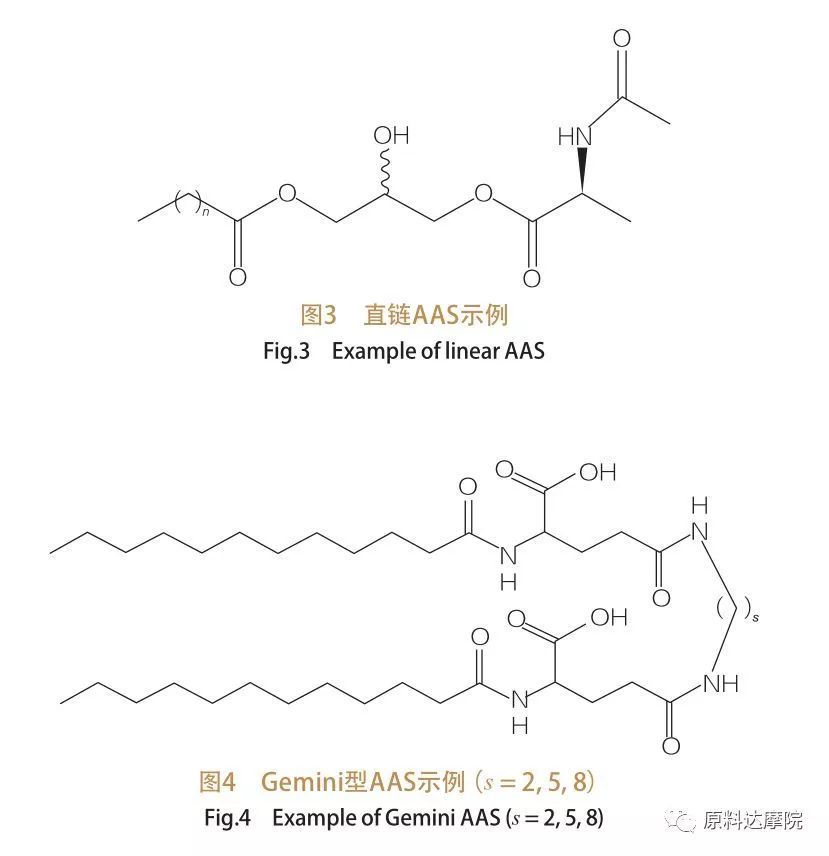
Sur la base du nombre de groupes de tête et de queues hydrophobes, l'AAS peut être divisé en quatre groupes.AAS à chaîne droite, AAS de type Gemini (dimère), AAS de type glycérolipide et AAS de type amphiphile bicéphale (Bola).les tensioactifs à chaîne droite sont des tensioactifs constitués d'acides aminés avec une seule queue hydrophobe (Figure 3).Les AAS de type Gemini ont deux groupes de tête polaires d'acides aminés et deux queues hydrophobes par molécule (Figure 4).Dans ce type de structure, les deux AAS linéaires sont reliés entre eux par un espaceur et sont donc également appelés dimères.Dans l'AAS de type glycérolipide, en revanche, les deux queues hydrophobes sont attachées au même groupe de tête d'acides aminés.Ces tensioactifs peuvent être considérés comme des analogues de monoglycérides, de diglycérides et de phospholipides, tandis que dans l'AAS de type Bola, deux groupes de tête d'acides aminés sont liés par une queue hydrophobe.
4.4 Selon le type de groupe de tête
①AAS cationique
Le groupe de tête de ce type de tensioactif a une charge positive.L'AAS cationique le plus ancien est l'arginate d'éthyle cocoyle, qui est un carboxylate de pyrrolidone.Les propriétés uniques et diverses de ce surfactant le rendent utile dans les désinfectants, les agents antimicrobiens, les agents antistatiques, les revitalisants capillaires, tout en étant doux pour les yeux et la peau et facilement biodégradable.Singare et Mhatre ont synthétisé des SAA cationiques à base d'arginine et évalué leurs propriétés physicochimiques.Dans cette étude, ils ont revendiqué des rendements élevés des produits obtenus en utilisant les conditions de réaction de Schotten-Baumann.Avec l'augmentation de la longueur de la chaîne alkyle et de l'hydrophobicité, l'activité de surface du surfactant s'est avérée augmenter et la concentration micellaire critique (cmc) diminuer.Un autre est la protéine acyle quaternaire, qui est couramment utilisée comme conditionneur dans les produits de soins capillaires.
②AAS anionique
Dans les tensioactifs anioniques, le groupe de tête polaire du tensioactif a une charge négative.La sarcosine (CH 3 -NH-CH 2 -COOH, N-méthylglycine), un acide aminé couramment présent dans les oursins et les étoiles de mer, est chimiquement liée à la glycine (NH 2 -CH 2 -COOH,), un acide aminé basique trouvé dans les cellules de mammifères.-COOH,) est chimiquement lié à la glycine, qui est un acide aminé basique présent dans les cellules de mammifères.L'acide laurique, l'acide tétradécanoïque, l'acide oléique et leurs halogénures et esters sont couramment utilisés pour synthétiser les tensioactifs sarcosinates.Les sarcosinates sont intrinsèquement doux et sont donc couramment utilisés dans les bains de bouche, les shampooings, les mousses à raser en spray, les écrans solaires, les nettoyants pour la peau et d'autres produits cosmétiques.
D'autres AAS anioniques disponibles dans le commerce comprennent Amisoft CS-22 et AmiliteGCK-12, qui sont des noms commerciaux pour le N-cocoyl-L-glutamate de sodium et le N-cocoyl glycinate de potassium, respectivement.L'amilite est couramment utilisée comme agent moussant, détergent, solubilisant, émulsifiant et dispersant, et a de nombreuses applications dans les cosmétiques, tels que les shampooings, les savons de bain, les nettoyants pour le corps, les dentifrices, les nettoyants pour le visage, les savons nettoyants, les nettoyants pour lentilles de contact et les tensioactifs ménagers.Amisoft est utilisé comme nettoyant doux pour la peau et les cheveux, principalement dans les nettoyants pour le visage et le corps, les détergents synthétiques en bloc, les produits de soins corporels, les shampooings et autres produits de soins de la peau.
③AAS zwitterionique ou amphotère
Les tensioactifs amphotères contiennent à la fois des sites acides et basiques et peuvent donc modifier leur charge en modifiant la valeur du pH.En milieu alcalin ils se comportent comme des tensioactifs anioniques, en milieu acide ils se comportent comme des tensioactifs cationiques et en milieu neutre comme des tensioactifs amphotères.La lauryl lysine (LL) et l'alcoxy (2-hydroxypropyl) arginine sont les seuls tensioactifs amphotères connus à base d'acides aminés.LL est un produit de condensation de la lysine et de l'acide laurique.En raison de sa structure amphotère, LL est insoluble dans presque tous les types de solvants, à l'exception des solvants très alcalins ou acides.En tant que poudre organique, LL a une excellente adhérence aux surfaces hydrophiles et un faible coefficient de frottement, conférant à ce tensioactif une excellente capacité de lubrification.LL est largement utilisé dans les crèmes pour la peau et les revitalisants capillaires, et est également utilisé comme lubrifiant.
④AAS non ionique
Les tensioactifs non ioniques sont caractérisés par des groupes de tête polaires sans charges formelles.huit nouveaux tensioactifs non ioniques éthoxylés ont été préparés par Al-Sabagh et al.à partir d'acides α-aminés solubles dans l'huile.Dans ce processus, la L-phénylalanine (LEP) et la L-leucine ont d'abord été estérifiées avec de l'hexadécanol, suivies d'une amidation avec de l'acide palmitique pour donner deux amides et deux esters d'acides α-aminés.Les amides et les esters ont ensuite subi des réactions de condensation avec l'oxyde d'éthylène pour préparer trois dérivés de la phénylalanine avec des nombres différents d'unités polyoxyéthylène (40, 60 et 100).Ces AAS non ioniques se sont avérés avoir de bonnes propriétés détergentes et moussantes.
05 Synthèse
5.1 Voie synthétique de base
Dans l'AAS, les groupes hydrophobes peuvent être attachés à des sites amine ou acide carboxylique, ou à travers les chaînes latérales d'acides aminés.Sur cette base, quatre voies synthétiques de base sont disponibles, comme le montre la figure 5.
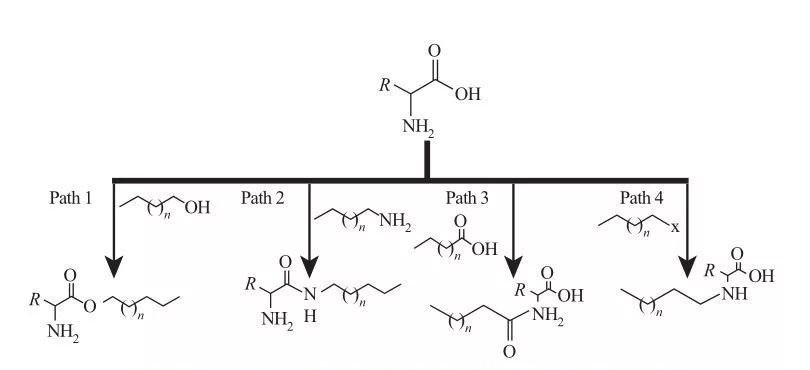
Fig.5 Voies fondamentales de synthèse des tensioactifs à base d'acides aminés
| Voie 1. Les amines esters amphiphiles sont produites par des réactions d'estérification, auquel cas la synthèse du tensioactif est généralement réalisée par reflux d'alcools gras et d'acides aminés en présence d'un agent déshydratant et d'un catalyseur acide.Dans certaines réactions, l'acide sulfurique agit à la fois comme catalyseur et comme agent déshydratant.
Voie 2. Les acides aminés activés réagissent avec les alkylamines pour former des liaisons amide, entraînant la synthèse d'amidoamines amphiphiles.
Voie 3. Les acides amido sont synthétisés en faisant réagir les groupes amine des acides aminés avec des acides amido.
Voie 4. Les alkylaminoacides à longue chaîne ont été synthétisés par la réaction de groupes amine avec des haloalcanes. |
5.2 Progrès dans la synthèse et la production
5.2.1 Synthèse de tensioactifs acides aminés/peptides monocaténaires
Les acides aminés N-acyle ou O-acyle ou les peptides peuvent être synthétisés par acylation catalysée par une enzyme de groupes amine ou hydroxyle avec des acides gras.Le premier rapport sur la synthèse catalysée par une lipase sans solvant d'amide d'acide aminé ou de dérivés d'ester méthylique utilisait Candida antarctica, avec des rendements allant de 25% à 90% selon l'acide aminé cible.La méthyléthylcétone a également été utilisée comme solvant dans certaines réactions.Vonderhagen et al.ont également décrit des réactions de N-acylation catalysées par des lipases et des protéases d'acides aminés, d'hydrolysats de protéines et/ou de leurs dérivés utilisant un mélange d'eau et de solvants organiques (par exemple, diméthylformamide/eau) et de méthylbutylcétone.
Au début, le principal problème de la synthèse catalysée par les enzymes de l'AAS était les faibles rendements.Selon Valivety et al.le rendement en dérivés d'acides aminés N-tétradécanoyl n'était que de 2 % à 10 % même après avoir utilisé différentes lipases et incubé à 70°C pendant plusieurs jours.Montet et al.ont également rencontré des problèmes concernant le faible rendement en acides aminés dans la synthèse de N-acyl lysine à l'aide d'acides gras et d'huiles végétales.Selon eux, le rendement maximal du produit était de 19 % dans des conditions sans solvant et en utilisant des solvants organiques.le même problème a été rencontré par Valivety et al.dans la synthèse de dérivés d'ester méthylique de N-Cbz-L-lysine ou de N-Cbz-lysine.
Dans cette étude, ils ont affirmé que le rendement en 3-O-tétradécanoyl-L-sérine était de 80% lors de l'utilisation de sérine N-protégée comme substrat et de Novozyme 435 comme catalyseur dans un environnement sans solvant fondu.Nagao et Kito ont étudié la O-acylation de la L-sérine, de la L-homosérine, de la L-thréonine et de la L-tyrosine (LET) lors de l'utilisation de la lipase Les résultats de la réaction (la lipase a été obtenue par Candida cylindracea et Rhizopus delemar dans un milieu tampon aqueux) et ont rapporté que les rendements d'acylation de la L-homosérine et de la L-sérine étaient quelque peu faibles, alors qu'aucune acylation de la L-thréonine et du LET ne s'est produite.
De nombreux chercheurs ont soutenu l'utilisation de substrats peu coûteux et facilement disponibles pour la synthèse d'AAS rentable.Soo et al.ont affirmé que la préparation de tensioactifs à base d'huile de palme fonctionne mieux avec une lipoenzyme immobilisée.Ils ont noté que le rendement des produits serait meilleur malgré la réaction longue (6 jours).Gerova et al.ont étudié la synthèse et l'activité de surface du N-palmitoyl AAS chiral basé sur la méthionine, la proline, la leucine, la thréonine, la phénylalanine et la phénylglycine dans un mélange cyclique/racémique.Pang et Chu ont décrit la synthèse de monomères à base d'acides aminés et de monomères à base d'acide dicarboxylique en solution Une série d'esters de polyamide à base d'acides aminés fonctionnels et biodégradables ont été synthétisés par des réactions de co-condensation en solution.
Cantaeuzene et Guerreiro ont rapporté l'estérification des groupes acides carboxyliques de Boc-Ala-OH et Boc-Asp-OH avec des alcools et des diols aliphatiques à longue chaîne, avec du dichlorométhane comme solvant et de l'agarose 4B (Sepharose 4B) comme catalyseur.Dans cette étude, la réaction de Boc-Ala-OH avec des alcools gras jusqu'à 16 carbones a donné de bons rendements (51%), tandis que pour Boc-Asp-OH 6 et 12 carbones étaient meilleurs, avec un rendement correspondant de 63% [64 ].99,9 %) avec des rendements allant de 58 % à 76 %, qui ont été synthétisés par la formation de liaisons amide avec diverses alkylamines à longue chaîne ou de liaisons ester avec des alcools gras par Cbz-Arg-OMe, où la papaïne a agi comme catalyseur.
5.2.2 Synthèse de tensioactifs acides aminés/peptides à base de gemini
Les tensioactifs gemini à base d'acides aminés sont constitués de deux molécules AAS à chaîne droite liées tête-à-tête l'une à l'autre par un groupe espaceur.Il existe 2 schémas possibles pour la synthèse chimioenzymatique de tensioactifs à base d'acides aminés de type gémeaux (figures 6 et 7).Sur la figure 6, 2 dérivés d'acides aminés sont mis à réagir avec le composé en tant que groupe espaceur, puis 2 groupes hydrophobes sont introduits.Sur la figure 7, les 2 structures à chaîne droite sont directement liées entre elles par un groupe espaceur bifonctionnel.
Le développement le plus précoce de la synthèse catalysée par des enzymes d'acides lipoaminés gémeaux a été lancé par Valivety et al.Yoshimura et al.ont étudié la synthèse, l'adsorption et l'agrégation d'un tensioactif gemini à base d'acides aminés à base de cystine et de bromure de n-alkyle.Les tensioactifs synthétisés ont été comparés aux tensioactifs monomères correspondants.Faustin et al.décrit la synthèse d'AAS monomère à base d'urée anionique basée sur la L-cystine, la D-cystine, la DL-cystine, la L-cystéine, la L-méthionine et la L-sulfoalanine et leurs paires de gémeaux au moyen de la conductivité, de la tension superficielle d'équilibre et de l'équilibre -caractérisation par fluorescence d'état de ceux-ci.Il a été démontré que la valeur cmc des gemini était inférieure en comparant le monomère et les gemini.
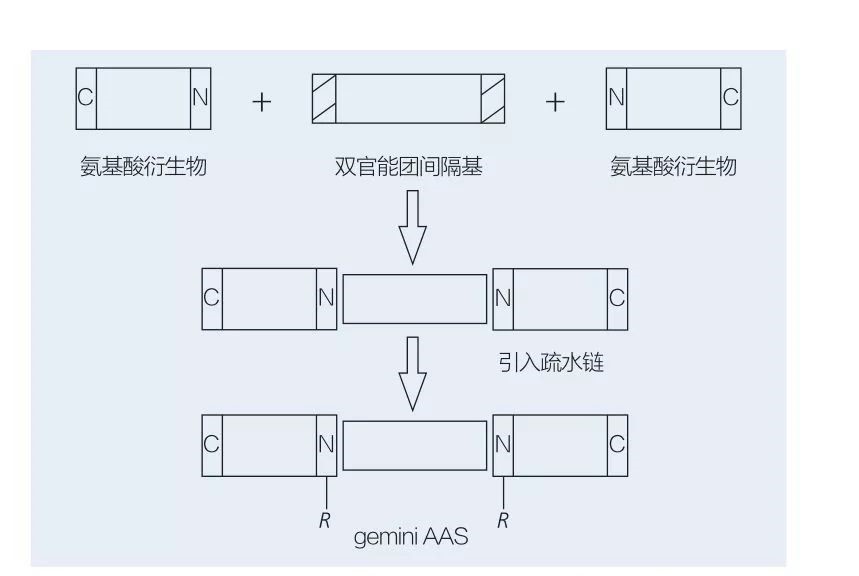
Fig.6 Synthèse de gemini AAS à l'aide de dérivés AA et d'un espaceur, suivie de l'insertion du groupe hydrophobe
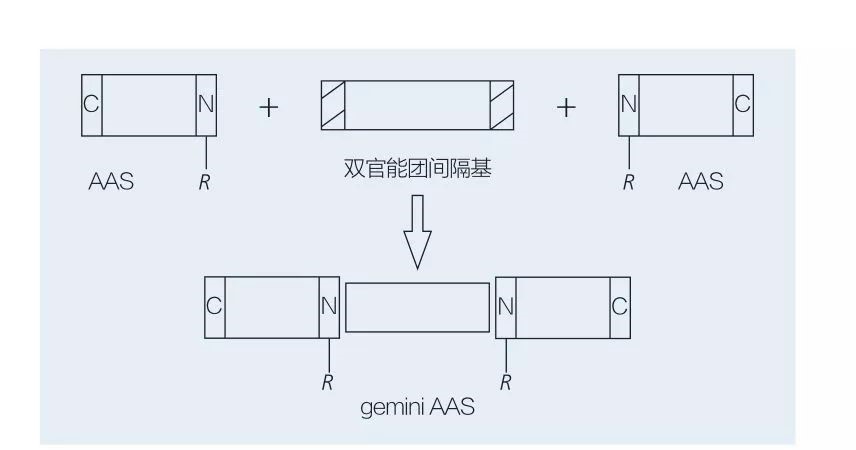
Fig.7 Synthèse d'AAS gemini à l'aide d'un espaceur bifonctionnel et d'AAS
5.2.3 Synthèse de tensioactifs acides aminés/peptides glycérolipidiques
Les tensioactifs acides aminés/peptides glycérolipidiques sont une nouvelle classe d'acides aminés lipidiques qui sont des analogues structuraux des mono- (ou di-)esters et des phospholipides du glycérol, en raison de leur structure d'une ou deux chaînes grasses avec un acide aminé lié au squelette du glycérol. par une liaison ester.La synthèse de ces tensioactifs commence par la préparation d'esters de glycérol d'acides aminés à des températures élevées et en présence d'un catalyseur acide (par exemple BF 3).La synthèse catalysée par des enzymes (utilisant des hydrolases, des protéases et des lipases comme catalyseurs) est également une bonne option (Figure 8).
La synthèse catalysée par une enzyme de conjugués de glycérides d'arginine dilaurylés à l'aide de papaïne a été rapportée.La synthèse de conjugués d'ester de diacylglycérol à partir d'acétylarginine et l'évaluation de leurs propriétés physicochimiques ont également été rapportées.
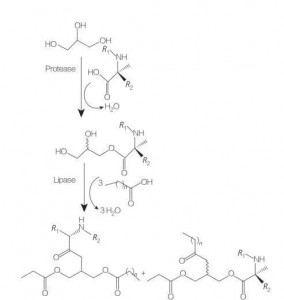
Fig.8 Synthèse de conjugués d'acides aminés mono et diacylglycérol
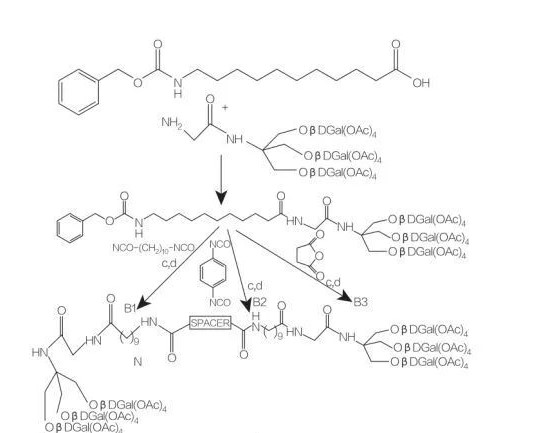
entretoise : NH-(CH2)10-NH : composé B1
entretoise : NH-C6H4-NH : composé B2
entretoise : CH2-CH2: composéB3
Fig.9 Synthèse d'amphiphiles symétriques dérivés du Tris(hydroxyméthyl)aminométhane
5.2.4 Synthèse de tensioactifs acides aminés/peptides à base de bola
Les amphiphiles de type bola à base d'acides aminés contiennent 2 acides aminés qui sont liés à la même chaîne hydrophobe.Franceschi et al.ont décrit la synthèse d'amphiphiles de type bola avec 2 acides aminés (D- ou L-alanine ou L-histidine) et 1 chaîne alkyle de différentes longueurs et ont étudié leur activité de surface.Ils discutent de la synthèse et de l'agrégation de nouveaux amphiphiles de type bola avec une fraction d'acides aminés (utilisant soit un acide β-aminé rare, soit un alcool) et un groupe espaceur C12 -C20.Les acides β-aminés peu courants utilisés peuvent être un acide aminé de sucre, un acide aminé dérivé de l'azidothymine (AZT), un acide aminé norbornène et un alcool aminé dérivé de l'AZT (Figure 9).la synthèse d'amphiphiles symétriques de type bola dérivés du tris(hydroxyméthyl)aminométhane (Tris) (Figure 9).
06 Propriétés physicochimiques
Il est bien connu que les tensioactifs à base d'acides aminés (AAS) sont de nature diverse et polyvalente et ont une bonne applicabilité dans de nombreuses applications telles qu'une bonne solubilisation, de bonnes propriétés d'émulsification, une efficacité élevée, des performances d'activité de surface élevées et une bonne résistance à l'eau dure (ion calcium tolérance).
Sur la base des propriétés tensioactives des acides aminés (par exemple, tension superficielle, cmc, comportement de phase et température de Krafft), les conclusions suivantes ont été tirées après des études approfondies - l'activité de surface de l'AAS est supérieure à celle de son homologue tensioactif conventionnel.
6.1 Concentration Micellaire Critique (cmc)
La concentration critique en micelles est l'un des paramètres importants des tensioactifs et régit de nombreuses propriétés tensioactives telles que la solubilisation, la lyse cellulaire et son interaction avec les biofilms, etc. dans la valeur cmc de la solution tensioactive, augmentant ainsi son activité de surface.Les tensioactifs à base d'acides aminés ont généralement des valeurs de cmc inférieures à celles des tensioactifs conventionnels.
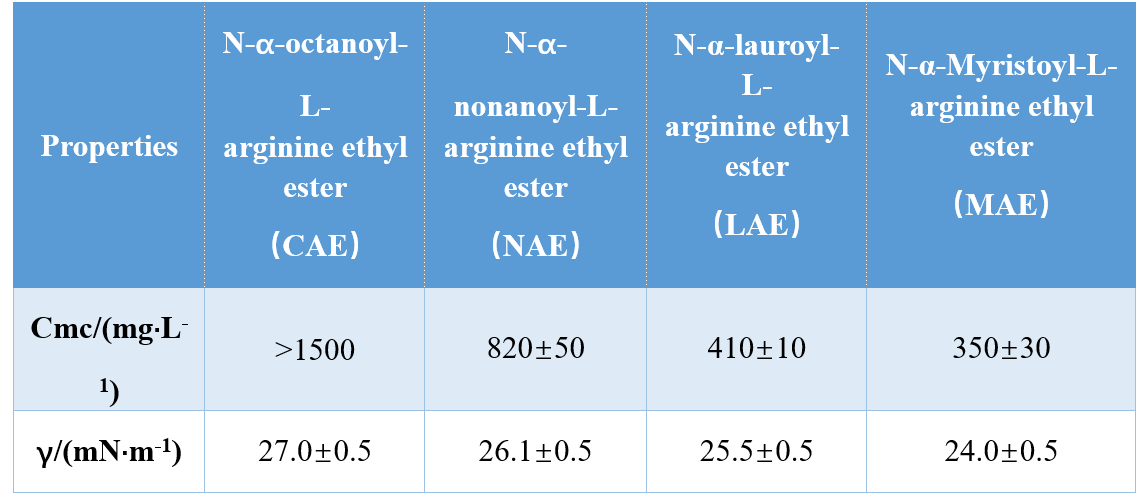
Grâce à différentes combinaisons de groupes de tête et de queues hydrophobes (amide mono-cationique, amide bi-cationique, ester à base d'amide bi-cationique), Infante et al.ont synthétisé trois AAS à base d'arginine et étudié leurs cmc et γcmc (tension superficielle à cmc), montrant que les valeurs de cmc et γcmc diminuaient avec l'augmentation de la longueur de la queue hydrophobe.Dans une autre étude, Singare et Mhatre ont découvert que la cmc des tensioactifs N-α-acylarginine diminuait avec l'augmentation du nombre d'atomes de carbone de queue hydrophobes (tableau 1).
Yoshimura et al.a étudié la cmc des tensioactifs gemini à base d'acides aminés dérivés de la cystéine et a montré que la cmc diminuait lorsque la longueur de la chaîne carbonée dans la chaîne hydrophobe passait de 10 à 12. Une augmentation supplémentaire de la longueur de la chaîne carbonée à 14 entraînait une augmentation de la cmc, qui a confirmé que les tensioactifs gemini à longue chaîne ont moins tendance à s'agréger.
Faustin et al.ont rapporté la formation de micelles mixtes dans des solutions aqueuses de tensioactifs géminés anioniques à base de cystine.Les tensioactifs gemini ont également été comparés aux tensioactifs monomères conventionnels correspondants (C8Cys).Les valeurs de cmc des mélanges lipides-tensioactifs étaient inférieures à celles des tensioactifs purs.les tensioactifs gemini et la 1,2-diheptanoyl-sn-glycéryl-3-phosphocholine, un phospholipide hydrosoluble formant des micelles, avaient une cmc au niveau millimolaire.
Shrestha et Aramaki ont étudié la formation de micelles viscoélastiques ressemblant à des vers dans des solutions aqueuses de tensioactifs anioniques-non ioniques à base d'acides aminés mixtes en l'absence de sels de mélange.Dans cette étude, le glutamate de N-dodécyle s'est avéré avoir une température de Krafft plus élevée;cependant, lorsqu'il est neutralisé avec l'acide aminé basique L-lysine, il génère des micelles et la solution commence à se comporter comme un fluide newtonien à 25 °C.
6.2 Bonne solubilité dans l'eau
La bonne solubilité dans l'eau de l'AAS est due à la présence de liaisons CO-NH supplémentaires.Cela rend l'AAS plus biodégradable et respectueux de l'environnement que les tensioactifs conventionnels correspondants.La solubilité dans l'eau de l'acide N-acyl-L-glutamique est encore meilleure en raison de ses 2 groupes carboxyle.La solubilité dans l'eau de Cn(CA) 2 est également bonne car il y a 2 groupes arginine ioniques dans 1 molécule, ce qui se traduit par une adsorption et une diffusion plus efficaces à l'interface cellulaire et même une inhibition bactérienne efficace à des concentrations plus faibles.
6.3 Température de Krafft et point de Krafft
La température de Krafft peut être comprise comme le comportement de solubilité spécifique des tensioactifs dont la solubilité augmente fortement au-dessus d'une température particulière.Les tensioactifs ioniques ont tendance à générer des hydrates solides, qui peuvent précipiter hors de l'eau.A une température particulière (la température dite de Krafft), une augmentation spectaculaire et discontinue de la solubilité des tensioactifs est généralement observée.Le point de Krafft d'un tensioactif ionique est sa température de Krafft à cmc.
Cette caractéristique de solubilité est généralement observée pour les tensioactifs ioniques et peut s'expliquer comme suit : la solubilité du monomère sans tensioactif est limitée en dessous de la température de Krafft jusqu'à ce que le point de Krafft soit atteint, où sa solubilité augmente progressivement en raison de la formation de micelles.Pour assurer une solubilité complète, il est nécessaire de préparer des formulations de tensioactifs à des températures supérieures au point de Krafft.
La température de Krafft de l'AAS a été étudiée et comparée à celle des tensioactifs synthétiques conventionnels. Shrestha et Aramaki ont étudié la température de Krafft de l'AAS à base d'arginine et ont constaté que la concentration critique de micelles présentait un comportement d'agrégation sous la forme de pré-micelles supérieures à 2-5 ×10-6 mol-L -1 suivi de la formation de micelles normales (Ohta et al. ont synthétisé six types différents de N-hexadécanoyl AAS et ont discuté de la relation entre leur température de Krafft et les résidus d'acides aminés.
Dans les expériences, il a été constaté que la température de Krafft du N-hexadécanoyl AAS augmentait avec la taille décroissante des résidus d'acides aminés (la phénylalanine étant une exception), tandis que la chaleur de solubilité (absorption de chaleur) augmentait avec la taille décroissante des résidus d'acides aminés (avec à l'exception de la glycine et de la phénylalanine).Il a été conclu que dans les systèmes alanine et phénylalanine, l'interaction DL est plus forte que l'interaction LL sous la forme solide du sel de N-hexadécanoyl AAS.
Brito et al.a déterminé la température de Krafft de trois séries de nouveaux tensioactifs à base d'acides aminés en utilisant la microcalorimétrie à balayage différentiel et a constaté que le changement de l'ion trifluoroacétate en ion iodure entraînait une augmentation significative de la température de Krafft (environ 6 ° C), de 47 ° C à 53 ° C CLa présence de doubles liaisons cis et l'insaturation présente dans les dérivés Ser à longue chaîne ont conduit à une diminution significative de la température de Krafft.Il a été rapporté que le glutamate de n-dodécyle avait une température de Krafft plus élevée.Cependant, la neutralisation avec l'acide aminé basique L-lysine a entraîné la formation de micelles en solution qui se sont comportées comme des fluides newtoniens à 25 °C.
6.4 Tension superficielle
La tension superficielle des tensioactifs est liée à la longueur de chaîne de la partie hydrophobe.Zhang et al.déterminé la tension superficielle du cocoyl glycinate de sodium par la méthode de la plaque de Wilhelmy (25 ± 0,2) °C et déterminé la valeur de la tension superficielle à cmc à 33 mN-m -1 , cmc à 0,21 mmol-L -1.Yoshimura et al.ont déterminé la tension superficielle de la tension superficielle à base d'acides aminés de type 2C n Cys d'agents tensioactifs à base de 2C n Cys.Il a été constaté que la tension superficielle à cmc diminuait avec l'augmentation de la longueur de la chaîne (jusqu'à n = 8), tandis que la tendance était inversée pour les tensioactifs avec n = 12 ou des longueurs de chaîne plus longues.
L'effet de CaC1 2 sur la tension superficielle des tensioactifs à base d'acides aminés dicarboxylés a également été étudié.Dans ces études, CaC1 2 a été ajouté à des solutions aqueuses de trois tensioactifs de type acide aminé dicarboxylé (C12 MalNa 2, C12 AspNa 2 et C12 GluNa 2).Les valeurs de plateau après cmc ont été comparées et il a été constaté que la tension superficielle diminuait à de très faibles concentrations de CaC1 2 .Ceci est dû à l'effet des ions calcium sur la disposition du tensioactif à l'interface gaz-eau.les tensions superficielles des sels de N-dodécylaminomalonate et de N-dodécylaspartate, d'autre part, étaient également presque constantes jusqu'à une concentration de CaC1 2 de 10 mmol-L -1 .Au-dessus de 10 mmol-L -1, la tension superficielle augmente fortement, du fait de la formation d'une précipitation du sel de calcium du tensioactif.Pour le sel disodique de glutamate de N-dodécyle, une addition modérée de CaC1 2 a entraîné une diminution significative de la tension superficielle, tandis qu'une augmentation continue de la concentration de CaC1 2 n'a plus provoqué de changements significatifs.
Pour déterminer la cinétique d'adsorption de l'AAS de type gemini à l'interface gaz-eau, la tension superficielle dynamique a été déterminée en utilisant la méthode de pression de bulle maximale.Les résultats ont montré que pendant la durée d'essai la plus longue, la tension superficielle dynamique du 2C 12 Cys n'a pas changé.La diminution de la tension superficielle dynamique ne dépend que de la concentration, de la longueur des queues hydrophobes et du nombre de queues hydrophobes.L'augmentation de la concentration de surfactant, la diminution de la longueur de la chaîne ainsi que le nombre de chaînes ont entraîné une décroissance plus rapide.Les résultats obtenus pour des concentrations plus élevées en C n Cys (n = 8 à 12) se sont avérés très proches de la γ cmc mesurée par la méthode de Wilhelmy.
Dans une autre étude, les tensions superficielles dynamiques de la dilauryl cystine sodique (SDLC) et de la didécamino cystine sodique ont été déterminées par la méthode de la plaque Wilhelmy, et en outre, les tensions superficielles à l'équilibre de leurs solutions aqueuses ont été déterminées par la méthode du volume de goutte.La réaction des liaisons disulfure a également été étudiée par d'autres méthodes.L'ajout de mercaptoéthanol à 0,1 mmol-L -1SDLC a entraîné une augmentation rapide de la tension superficielle de 34 mN-m -1 à 53 mN-m -1.Étant donné que NaClO peut oxyder les liaisons disulfure de SDLC en groupes d'acide sulfonique, aucun agrégat n'a été observé lorsque NaClO (5 mmol-L -1 ) a été ajouté à la solution de 0,1 mmol-L -1 SDLC.Les résultats de la microscopie électronique à transmission et de la diffusion dynamique de la lumière ont montré qu'aucun agrégat ne s'était formé dans la solution.La tension superficielle du SDLC a augmenté de 34 mN-m -1 à 60 mN-m -1 sur une période de 20 min.
6.5 Interactions binaires surfaciques
Dans les sciences de la vie, un certain nombre de groupes ont étudié les propriétés vibrationnelles de mélanges d'AAS cationiques (tensioactifs à base de diacylglycérol arginine) et de phospholipides à l'interface gaz-eau, concluant finalement que cette propriété non idéale provoque la prévalence des interactions électrostatiques.
6.6 Propriétés d'agrégation
La diffusion dynamique de la lumière est couramment utilisée pour déterminer les propriétés d'agrégation des monomères à base d'acides aminés et des tensioactifs gemini à des concentrations supérieures à cmc, donnant un diamètre hydrodynamique apparent DH (= 2R H ).Les agrégats formés par C n Cys et 2Cn Cys sont relativement gros et ont une distribution à grande échelle par rapport aux autres tensioactifs.Tous les tensioactifs à l'exception du 2C 12 Cys forment généralement des agrégats d'environ 10 nm.les tailles des micelles des tensioactifs gemini sont significativement plus grandes que celles de leurs homologues monomères.Une augmentation de la longueur de la chaîne hydrocarbonée entraîne également une augmentation de la taille des micelles.Ohta et al.décrit les propriétés d'agrégation de trois stéréoisomères différents de N-dodécyl-phényl-alanyl-phényl-alanine tétraméthylammonium en solution aqueuse et a montré que les diastéréoisomères ont la même concentration critique d'agrégation en solution aqueuse.Iwahashi et al.étudié par dichroïsme circulaire, RMN et osmométrie à pression de vapeur La formation d'agrégats chiraux d'acide N-dodécanoyl-L-glutamique, de N-dodécanoyl-L-valine et de leurs esters méthyliques dans différents solvants (tels que le tétrahydrofurane, l'acétonitrile, le 1,4 -dioxane et 1,2-dichloroéthane) avec des propriétés rotationnelles a été étudiée par dichroïsme circulaire, RMN et osmométrie à pression de vapeur.
6.7 Adsorption interfaciale
L'adsorption interfaciale des tensioactifs à base d'acides aminés et sa comparaison avec son homologue conventionnel est également l'une des directions de recherche.Par exemple, les propriétés d'adsorption interfaciale des esters dodécyliques d'acides aminés aromatiques obtenus à partir du LET et du LEP ont été étudiées.Les résultats ont montré que le LET et le LEP présentaient des zones interfaciales plus faibles à l'interface gaz-liquide et à l'interface eau/hexane, respectivement.
Bordes et al.ont étudié le comportement en solution et l'adsorption à l'interface gaz-eau de trois tensioactifs acides aminés dicarboxylés, les sels disodiques de glutamate de dodécyle, d'aspartate de dodécyle et d'aminomalonate (avec 3, 2 et 1 atomes de carbone entre les deux groupes carboxyle, respectivement).Selon ce rapport, la cmc des tensioactifs dicarboxylés était 4 à 5 fois supérieure à celle du sel de dodécyl glycine monocarboxylé.Ceci est attribué à la formation de liaisons hydrogène entre les tensioactifs dicarboxylés et les molécules voisines par l'intermédiaire des groupes amide qu'ils contiennent.
6.8 Comportement des phases
Des phases cubiques discontinues isotropes sont observées pour les tensioactifs à très fortes concentrations.Les molécules de surfactant avec de très grands groupes de tête ont tendance à former des agrégats de plus petite courbure positive.Marques et al.ont étudié le comportement de phase des systèmes 12Lys12/12Ser et 8Lys8/16Ser (voir Figure 10), et les résultats ont montré que le système 12Lys12/12Ser a une zone de séparation de phase entre les régions de la solution micellaire et vésiculaire, tandis que le système 8Lys8/16Ser Le système 8Lys8/16Ser présente une transition continue (région de phase micellaire allongée entre la petite région de phase micellaire et la région de phase vésiculaire).Il convient de noter que pour la région des vésicules du système 12Lys12/12Ser, les vésicules coexistent toujours avec les micelles, tandis que la région des vésicules du système 8Lys8/16Ser n'a que des vésicules.
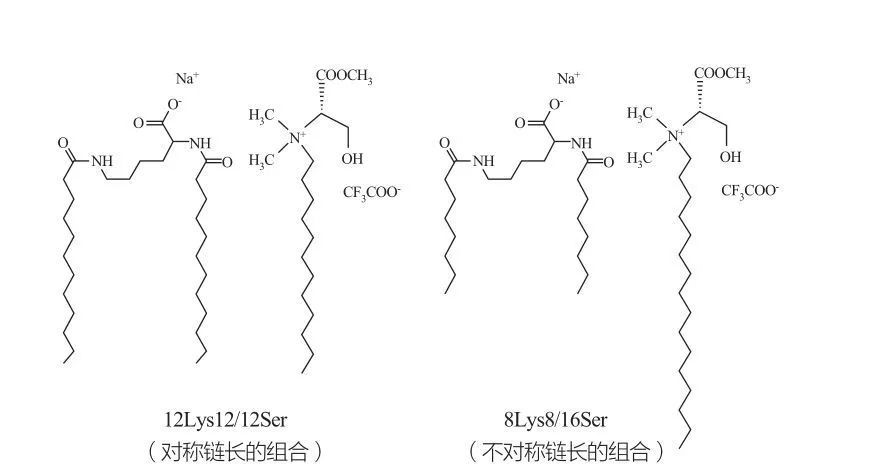
Mélanges catanioniques des tensioactifs à base de lysine et de sérine : paire symétrique 12Lys12/12Ser (gauche) et paire asymétrique 8Lys8/16Ser (droite)
6.9 Pouvoir émulsifiant
Kouchi et al.ont examiné la capacité émulsifiante, la tension interfaciale, la dispersibilité et la viscosité de la N-[3-dodécyl-2-hydroxypropyl]-L-arginine, du L-glutamate et d'autres AAS.En comparaison avec les tensioactifs synthétiques (leurs homologues conventionnels non ioniques et amphotères), les résultats ont montré que les AAS ont une capacité émulsifiante plus forte que les tensioactifs conventionnels.
Baczko et al.synthétisé de nouveaux tensioactifs d'acides aminés anioniques et étudié leur pertinence en tant que solvants de spectroscopie RMN à orientation chirale.Une série de dérivés amphiphiles L-Phe ou L-Ala à base de sulfonates avec différentes queues hydrophobes (pentyl~tétradécyle) ont été synthétisés en faisant réagir des acides aminés avec de l'anhydride o-sulfobenzoïque.Wu et al.sels de sodium synthétisés de N-acide gras AAS etont étudié leur capacité d'émulsification dans des émulsions huile-dans-eau, et les résultats ont montré que ces tensioactifs fonctionnaient mieux avec l'acétate d'éthyle comme phase huileuse qu'avec le n-hexane comme phase huileuse.
6.10 Progrès dans la synthèse et la production
La résistance à l'eau dure peut être comprise comme la capacité des tensioactifs à résister à la présence d'ions tels que le calcium et le magnésium dans l'eau dure, c'est-à-dire la capacité à éviter la précipitation dans les savons de calcium.Les tensioactifs à haute résistance à l'eau dure sont très utiles pour les formulations détergentes et les produits de soins personnels.La résistance à l'eau dure peut être évaluée en calculant le changement de solubilité et d'activité de surface du surfactant en présence d'ions calcium.
Une autre façon d'évaluer la résistance à l'eau dure consiste à calculer le pourcentage ou les grammes de tensioactif nécessaires pour que le savon de calcium formé à partir de 100 g d'oléate de sodium soit dispersé dans l'eau.Dans les zones où l'eau est très dure, les fortes concentrations d'ions calcium et magnésium et la teneur en minéraux peuvent rendre certaines applications pratiques difficiles.Souvent, l'ion sodium est utilisé comme contre-ion d'un tensioactif anionique synthétique.Étant donné que l'ion calcium divalent est lié aux deux molécules de tensioactif, il provoque la précipitation du tensioactif plus facilement de la solution, ce qui rend la détergence moins probable.
L'étude de la résistance à l'eau dure de l'AAS a montré que la résistance à l'acide et à l'eau dure était fortement influencée par un groupe carboxyle supplémentaire, et que la résistance à l'acide et à l'eau dure augmentait encore avec l'augmentation de la longueur du groupe espaceur entre les deux groupes carboxyle. .L'ordre de résistance à l'acide et à l'eau dure était C 12 glycinate < C 12 aspartate < C 12 glutamate.En comparant la liaison amide dicarboxylée et le tensioactif amino dicarboxylé, respectivement, on a trouvé que la plage de pH de ce dernier était plus large et que son activité de surface augmentait avec l'addition d'une quantité appropriée d'acide.Les acides aminés N-alkylés dicarboxylés ont montré un effet chélatant en présence d'ions calcium, et l'aspartate de C 12 a formé un gel blanc.Le glutamate c 12 a montré une activité de surface élevée à une concentration élevée de Ca 2+ et devrait être utilisé dans le dessalement de l'eau de mer.
6.11 Dispersibilité
La dispersibilité fait référence à la capacité d'un tensioactif à empêcher la coalescence et la sédimentation du tensioactif en solution.La dispersibilité est une propriété importante des tensioactifs qui les rend utilisables dans les détergents, les cosmétiques et les produits pharmaceutiques.Un agent dispersant doit contenir une liaison ester, éther, amide ou amino entre le groupe hydrophobe et le groupe hydrophile terminal (ou parmi les groupes hydrophobes à chaîne droite).
Généralement, les tensioactifs anioniques tels que les alcanolamido sulfates et les tensioactifs amphotères tels que l'amidosulfobétaïne sont particulièrement efficaces comme agents dispersants pour les savons de calcium.
De nombreux efforts de recherche ont déterminé la dispersibilité de l'AAS, où la N-lauroyl lysine s'est avérée peu compatible avec l'eau et difficile à utiliser pour les formulations cosmétiques.Dans cette série, les acides aminés basiques N-acyl-substitués ont une excellente dispersibilité et sont utilisés dans l'industrie cosmétique pour améliorer les formulations.
07 Toxicité
Les tensioactifs conventionnels, en particulier les tensioactifs cationiques, sont hautement toxiques pour les organismes aquatiques.Leur toxicité aiguë est due au phénomène d'interaction adsorption-ion des tensioactifs à l'interface cellule-eau.La diminution de la cmc des tensioactifs conduit généralement à une adsorption interfaciale plus forte des tensioactifs, ce qui entraîne généralement leur toxicité aiguë élevée.Une augmentation de la longueur de la chaîne hydrophobe des tensioactifs entraîne également une augmentation de la toxicité aiguë des tensioactifs.La plupart des SAA sont peu toxiques ou non toxiques pour les humains et l'environnement (en particulier pour les organismes marins) et peuvent être utilisés comme ingrédients alimentaires, pharmaceutiques et cosmétiques.De nombreux chercheurs ont démontré que les tensioactifs à base d'acides aminés sont doux et non irritants pour la peau.Les tensioactifs à base d'arginine sont connus pour être moins toxiques que leurs homologues conventionnels.
Brito et al.ont étudié les propriétés physicochimiques et toxicologiques des amphiphiles à base d'acides aminés et leur [dérivés de la tyrosine (Tyr), de l'hydroxyproline (Hyp), de la sérine (Ser) et de la lysine (Lys)] la formation spontanée de vésicules cationiques et ont donné des données sur leur toxicité aiguë pour Daphnia magna (IC 50).Ils ont synthétisé des vésicules cationiques de bromure de dodécyltriméthylammonium (DTAB)/dérivés de Lys et/ou des mélanges de dérivés de Ser-/Lys et ont testé leur écotoxicité et leur potentiel hémolytique, montrant que tous les AAS et leurs mélanges contenant des vésicules étaient moins toxiques que le surfactant conventionnel DTAB. .
Rose et al.ont étudié la liaison (association) de l'ADN à des vésicules cationiques stables à base d'acides aminés.Contrairement aux tensioactifs cationiques conventionnels, qui semblent souvent être toxiques, l'interaction des tensioactifs cationiques d'acides aminés semble être non toxique.L'AAS cationique est à base d'arginine, qui forme spontanément des vésicules stables en association avec certains tensioactifs anioniques.Les inhibiteurs de corrosion à base d'acides aminés sont également signalés comme étant non toxiques.Ces tensioactifs sont facilement synthétisés avec une grande pureté (jusqu'à 99%), à faible coût, facilement biodégradables et complètement solubles dans les milieux aqueux.Plusieurs études ont montré que les tensioactifs d'acides aminés contenant du soufre sont supérieurs dans l'inhibition de la corrosion.
Dans une étude récente, Perinelli et al.ont rapporté un profil toxicologique satisfaisant des rhamnolipides par rapport aux tensioactifs conventionnels.Les rhamnolipides sont connus pour agir comme activateurs de perméabilité.Ils ont également rapporté l'effet des rhamnolipides sur la perméabilité épithéliale des médicaments macromoléculaires.
08 Activité antimicrobienne
L'activité antimicrobienne des tensioactifs peut être évaluée par la concentration minimale inhibitrice.L'activité antimicrobienne des tensioactifs à base d'arginine a été étudiée en détail.Les bactéries Gram-négatives se sont avérées plus résistantes aux tensioactifs à base d'arginine que les bactéries Gram-positives.L'activité antimicrobienne des tensioactifs est généralement augmentée par la présence de liaisons hydroxyle, cyclopropane ou insaturées dans les chaînes acyle.Castillo et al.ont montré que la longueur des chaînes acyle et la charge positive déterminent la valeur HLB (balance hydrophile-lipophile) de la molécule, et que celles-ci ont un effet sur leur capacité à perturber les membranes.L'ester méthylique de Nα-acylarginine est une autre classe importante de tensioactifs cationiques ayant une activité antimicrobienne à large spectre et il est facilement biodégradable et a une toxicité faible ou nulle.Études sur l'interaction des tensioactifs à base d'ester méthylique de Nα-acylarginine avec la 1,2-dipalmitoyl-sn-propyltrioxyl-3-phosphorylcholine et la 1,2-ditetradecanoyl-sn-propyltrioxyl-3-phosphorylcholine, membranes modèles, et avec des organismes vivants dans la présence ou l'absence de barrières externes ont montré que cette classe de tensioactifs a une bonne activité antimicrobienne Les résultats ont montré que les tensioactifs ont une bonne activité antibactérienne.
09 Propriétés rhéologiques
Les propriétés rhéologiques des tensioactifs jouent un rôle très important dans la détermination et la prédiction de leurs applications dans différentes industries, notamment l'alimentation, les produits pharmaceutiques, l'extraction de pétrole, les soins personnels et les produits d'entretien ménager.De nombreuses études ont été menées pour discuter de la relation entre la viscoélasticité des tensioactifs d'acides aminés et la cmc.
10 Applications dans l'industrie cosmétique
Les SAA sont utilisés dans la formulation de nombreux produits de soins personnels.Le N-cocoyl glycinate de potassium est doux pour la peau et est utilisé dans le nettoyage du visage pour éliminer les boues et le maquillage.L'acide n-acyl-L-glutamique a deux groupes carboxyle, ce qui le rend plus soluble dans l'eau.Parmi ces SAA, les SAA à base d'acides gras en C 12 sont largement utilisées dans le nettoyage du visage pour éliminer les boues et le maquillage.Les AAS avec une chaîne en C 18 sont utilisés comme émulsifiants dans les produits de soins de la peau, et les sels de N-Lauryl alanine sont connus pour créer des mousses crémeuses qui ne sont pas irritantes pour la peau et peuvent donc être utilisées dans la formulation de produits de soins pour bébés.Les AAS à base de N-Lauryl utilisés dans les dentifrices ont une bonne détergence similaire au savon et une forte efficacité d'inhibition des enzymes.
Au cours des dernières décennies, le choix des tensioactifs pour les cosmétiques, les produits de soins personnels et les produits pharmaceutiques s'est concentré sur la faible toxicité, la douceur, la douceur au toucher et la sécurité.Les consommateurs de ces produits sont parfaitement conscients de l'irritation potentielle, de la toxicité et des facteurs environnementaux.
Aujourd'hui, les AAS sont utilisés pour formuler de nombreux shampooings, teintures capillaires et savons de bain en raison de leurs nombreux avantages par rapport à leurs homologues traditionnels dans les cosmétiques et les produits de soins personnels.Les tensioactifs à base de protéines ont des propriétés souhaitables nécessaires pour les produits de soins personnels.Certains AAS ont des capacités de formation de film, tandis que d'autres ont de bonnes capacités de moussage.
Les acides aminés sont des facteurs hydratants naturels importants dans la couche cornée.Lorsque les cellules épidermiques meurent, elles font partie de la couche cornée et les protéines intracellulaires sont progressivement dégradées en acides aminés.Ces acides aminés sont ensuite transportés plus loin dans la couche cornée, où ils absorbent les matières grasses ou analogues à la graisse dans la couche cornée épidermique, améliorant ainsi l'élasticité de la surface de la peau.Environ 50% du facteur hydratant naturel de la peau est composé d'acides aminés et de pyrrolidone.
Le collagène, un ingrédient cosmétique commun, contient également des acides aminés qui gardent la peau douce.Les problèmes de peau tels que la rugosité et la matité sont dus en grande partie à un manque d'acides aminés.Une étude a montré que le mélange d'un acide aminé avec une pommade soulageait les brûlures cutanées et que les zones touchées revenaient à leur état normal sans devenir des cicatrices chéloïdes.
Les acides aminés se sont également révélés très utiles pour soigner les cuticules endommagées.Les cheveux secs et informes peuvent indiquer une diminution de la concentration d'acides aminés dans une couche cornée gravement endommagée.Les acides aminés ont la capacité de pénétrer la cuticule dans la tige du cheveu et d'absorber l'humidité de la peau.Cette capacité des tensioactifs à base d'acides aminés les rend très utiles dans les shampooings, les teintures capillaires, les adoucissants, les après-shampooings et la présence d'acides aminés rend les cheveux plus forts.
11 Applications en cosmétique de tous les jours
Actuellement, il existe une demande croissante de formulations détergentes à base d'acides aminés dans le monde entier.Les AAS sont connus pour avoir une meilleure capacité de nettoyage, une capacité moussante et des propriétés d'adoucissement des tissus, ce qui les rend appropriés pour les détergents ménagers, les shampooings, les nettoyants pour le corps et d'autres applications.Un AAS amphotère dérivé de l'acide aspartique est signalé comme étant un détergent très efficace avec des propriétés chélatantes.L'utilisation d'ingrédients détergents constitués d'acides N-alkyl-β-aminoéthoxy s'est avérée réduire l'irritation cutanée.Une formulation de détergent liquide constituée de N-cocoyl-β-aminopropionate a été signalée comme étant un détergent efficace pour les taches d'huile sur les surfaces métalliques.Un tensioactif acide aminocarboxylique, C 14 CHOHCH 2 NHCH 2 COONa, s'est également avéré avoir une meilleure détergence et est utilisé pour nettoyer les textiles, les tapis, les cheveux, le verre, etc. L'acide 2-hydroxy-3-aminopropionique-N,N- le dérivé d'acide acétoacétique est connu pour avoir une bonne capacité de complexation et donne ainsi une stabilité aux agents de blanchiment.
La préparation de formulations détergentes à base de N-(N'-acyl-β-alanyl)-β-alanine a été rapportée par Keigo et Tatsuya dans leur brevet pour une meilleure capacité de lavage et stabilité, une rupture facile de la mousse et un bon assouplissement des tissus. .Kao a développé une formulation détergente à base de N-Acyl-1-N-hydroxy-β-alanine et a signalé une faible irritation cutanée, une résistance élevée à l'eau et un pouvoir détachant élevé.
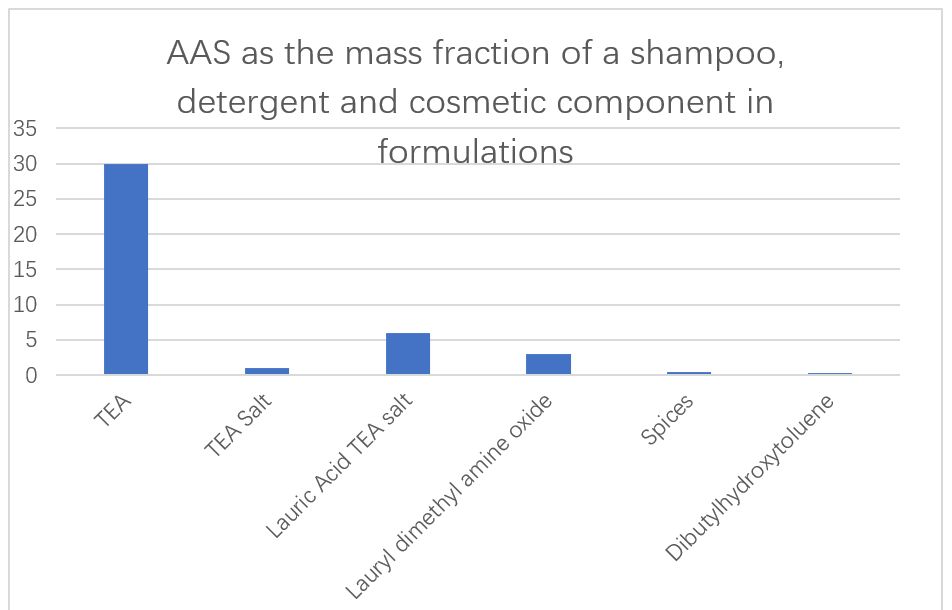
La société japonaise Ajinomoto utilise des SAA peu toxiques et facilement dégradables à base d'acide L-glutamique, de L-arginine et de L-lysine comme ingrédients principaux dans les shampooings, les détergents et les cosmétiques (Figure 13).La capacité des additifs enzymatiques dans les formulations détergentes à éliminer l'encrassement des protéines a également été rapportée.Les N-acyl AAS dérivés de l'acide glutamique, de l'alanine, de la méthylglycine, de la sérine et de l'acide aspartique ont été rapportés pour leur utilisation comme excellents détergents liquides dans des solutions aqueuses.Ces tensioactifs n'augmentent pas du tout la viscosité, même à très basse température, et peuvent être facilement transférés de la cuve de stockage du dispositif de moussage pour obtenir des mousses homogènes.
Heure de publication : 09-juin-2022

