Table des matières pour cet article:
1. Développement des acides aminés
2. Propriétés structurelles
3. Composition chimique
4.Classification
5. Synthèse
6. Propriétés physicochimiques
7. Toxicité
8. Activité antimicrobienne
9. Propriétés rhéologiques
10. Applications dans l'industrie cosmétique
11. Applications dans les cosmétiques de tous les jours
Surfactants d'acide aminé (AAS)sont une classe de tensioactifs formés en combinant des groupes hydrophobes avec un ou plusieurs acides aminés. Dans ce cas, les acides aminés peuvent être synthétiques ou dérivés des hydrolysats de protéines ou des sources renouvelables similaires. Cet article couvre les détails de la plupart des voies synthétiques disponibles pour les AA et l'effet de différentes voies sur les propriétés physicochimiques des produits finaux, y compris la solubilité, la stabilité de la dispersion, la toxicité et la biodégradabilité. En tant que classe de tensioactifs dans la demande croissante, la polyvalence de l'AAS en raison de leur structure variable offre un grand nombre d'opportunités commerciales.
Étant donné que les tensioactifs sont largement utilisés dans les détergents, les émulsifiants, les inhibiteurs de la corrosion, la récupération d'huile tertiaire et les produits pharmaceutiques, les chercheurs n'ont jamais cessé de prêter attention aux tensioactifs.
Les tensioactifs sont les produits chimiques les plus représentatifs qui sont consommés en grande quantité quotidiennement dans le monde et ont eu un impact négatif sur l'environnement aquatique.Des études ont montré que l'utilisation généralisée des tensioactifs traditionnels peut avoir un impact négatif sur l'environnement.
Aujourd'hui, la non-toxicité, la biodégradabilité et la biocompatibilité sont presque aussi importantes pour les consommateurs que l'utilité et les performances des tensioactifs.
Les biosurfactants sont des tensioactifs durables respectueux de l'environnement qui sont naturellement synthétisés par des micro-organismes tels que les bactéries, les champignons et la levure, ou sécrétés extracellulaires.Par conséquent, les biosurfactants peuvent également être préparés par conception moléculaire pour imiter les structures amphiphiles naturelles, telles que les phospholipides, les glycosides alkyl et les acides d'amino acyl.
Surfactants d'acide aminé (AAS)sont l'un des tensioactifs typiques, généralement produits à partir de matières premières animales ou dérivées de l'agriculture. Au cours des deux dernières décennies, les AA ont suscité beaucoup d'intérêt de la part des scientifiques comme de nouveaux tensioactifs, non seulement parce qu'ils peuvent être synthétisés à partir de ressources renouvelables, mais aussi parce que les AA sont facilement dégradables et ont des sous-produits inoffensifs, ce qui les rend plus sûrs pour l'environnement.
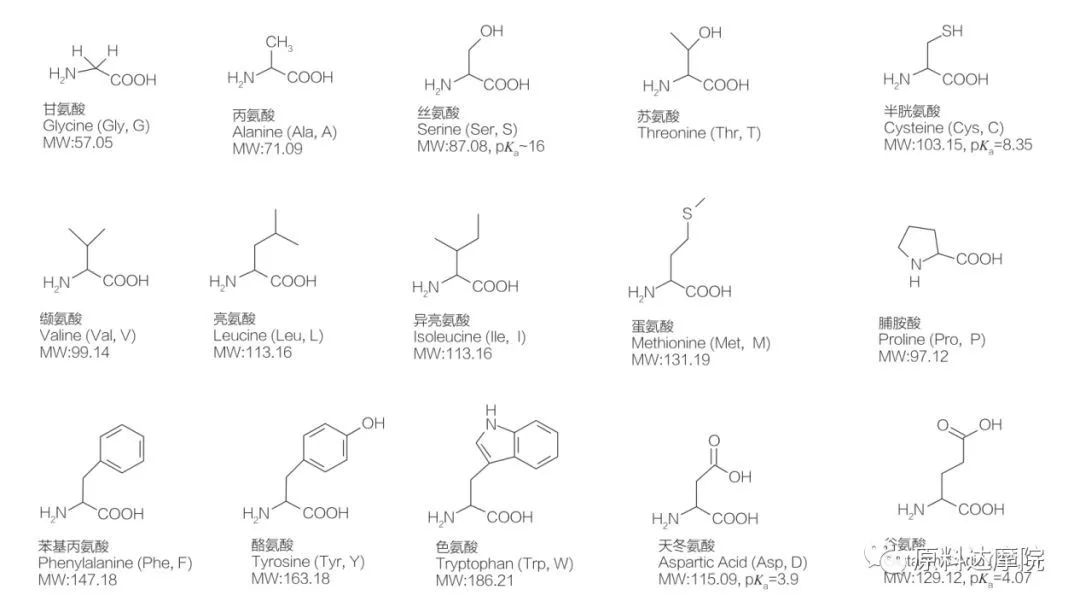
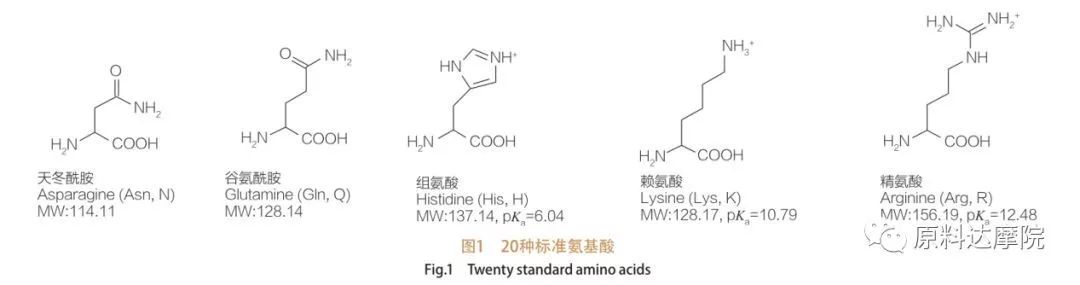
Les AA peuvent être définis comme une classe de tensioactifs constitués d'acides aminés contenant des groupes d'acides aminés (HO 2 C-CHR-NH 2) ou des résidus d'acides aminés (HO 2 C-CHR-NH-). Les 2 régions fonctionnelles des acides aminés permettent la dérivation d'une grande variété de tensioactifs. Un total de 20 acides aminés protéinogènes standard sont connus pour exister dans la nature et sont responsables de toutes les réactions physiologiques des activités de croissance et de vie. Ils ne diffèrent les uns des autres uniquement selon le résidu R (figure 1, PK A est le logarithme négatif de la constante de dissociation acide de la solution). Certains sont non polaires et hydrophobes, certains sont polaires et hydrophiles, certains sont basiques et certains sont acides.
Parce que les acides aminés sont des composés renouvelables, les surfactants synthétisés à partir des acides aminés ont également un potentiel élevé pour devenir durable et respectueux de l'environnement. La structure simple et naturelle, la faible toxicité et la biodégradabilité rapide les rendent souvent supérieurs aux tensioactifs conventionnels. En utilisant des matières premières renouvelables (par exemple, les acides aminés et les huiles végétales), l'AAS peut être produit par différentes voies biotechnologiques et voies chimiques.
Au début du 20e siècle, les acides aminés ont d'abord été découverts comme substrats pour la synthèse des tensioactifs.Les AA étaient principalement utilisés comme conservateurs dans les formulations pharmaceutiques et cosmétiques.De plus, les AA se sont révélés biologiquement actifs contre une variété de bactéries, de tumeurs et de virus qui entraînent une maladie. En 1988, la disponibilité des AAS à faible coût a suscité l'intérêt de la recherche dans l'activité de surface. Aujourd'hui, avec le développement de la biotechnologie, certains acides aminés peuvent également être synthétisés commercialement à grande échelle par la levure, ce qui prouve indirectement que la production d'AAS est plus respectueuse de l'environnement.
01 Développement d'acides aminés
Dès le début du XIXe siècle, lorsque les acides aminés naturels ont été découverts pour la première fois, leurs structures devraient être extrêmement précieuses - utilisables comme matières premières pour la préparation des amphiphiles. La première étude sur la synthèse de l'AAS a été rapportée par Bondi en 1909.
Dans cette étude, la N-acylglycine et la n-acylalanine ont été introduites comme groupes hydrophiles pour les tensioactifs. Les travaux ultérieurs impliquaient la synthèse des acides lipoaminés (AAS) en utilisant la glycine et l'alanine, et Hentrich et al. a publié une série de résultats,y compris la première demande de brevet, sur l'utilisation des sels de sarcosinate acyle et d'aspartate acyle comme tensioactifs dans les produits de nettoyage des ménages (par exemple, shampooings, détergents et dentifrices).Par la suite, de nombreux chercheurs ont étudié la synthèse et les propriétés physicochimiques des acides d'acyl-aminés. À ce jour, un grand corps de littérature a été publié sur la synthèse, les propriétés, les applications industrielles et la biodégradabilité de l'AAS.
02 Propriétés structurelles
Les chaînes d'acides gras hydrophobes non polaires des AA peuvent varier en structure, en longueur de chaîne et en nombre.La diversité structurelle et l'activité de surface élevée des AA expliquent leur large diversité de composition et leurs propriétés physicochimiques et biologiques. Les groupes de tête d'AAS sont composés d'acides aminés ou de peptides. Les différences dans les groupes de tête déterminent l'adsorption, l'agrégation et l'activité biologique de ces tensioactifs. Les groupes fonctionnels du groupe de tête déterminent ensuite le type d'AAS, y compris cationique, anionique, non ionique et amphotérique. La combinaison des acides aminés hydrophiles et des parties hydrophobes à chaîne longue forment une structure amphiphile qui rend la molécule très active. De plus, la présence d'atomes de carbone asymétriques dans la molécule aide à former des molécules chirales.
03 Composition chimique
Tous les peptides et polypeptides sont les produits de polymérisation de ces près de 20 acides α-aminés α-protéinogènes. Les 20 acides α-aminés contiennent un groupe fonctionnel acide carboxylique (-COOH) et un groupe fonctionnel amino (-NH 2), tous deux attachés au même atome de carbone α tétraédrique. Les acides aminés diffèrent les uns des autres par les différents groupes R attachés au carbone α (à l'exception de la lycine, où le groupe R est de l'hydrogène.) Les groupes R peuvent différer en structure, en taille et en charge (acidité, alcalinité). Ces différences déterminent également la solubilité des acides aminés dans l'eau.
Les acides aminés sont chiraux (à l'exception de la glycine) et sont optiquement actifs par nature car ils ont quatre substituants différents liés au carbone alpha. Les acides aminés ont deux conformations possibles; Ce sont des images miroir non chevauchantes les unes des autres, malgré le fait que le nombre de l-stéréoisomères est nettement plus élevé. Le groupe R présent dans certains acides aminés (phénylalanine, tyrosine et tryptophane) est aryle, conduisant à une absorption UV maximale à 280 nm. Le α-COOH acide et le α-NH 2 de base dans les acides aminés sont capables d'ionisation, et les deux stéréoisomères, selon lesquels ils sont, construisez l'équilibre d'ionisation illustré ci-dessous.
R-COOH ↔r-COO-+ H+
R-nh3+↔r-nh2+ H+
Comme le montre l'équilibre d'ionisation ci-dessus, les acides aminés contiennent au moins deux groupes faiblement acides; Cependant, le groupe carboxyle est beaucoup plus acide par rapport au groupe amino protoné. pH 7,4, le groupe carboxyle est déprotoné tandis que le groupe amino est protoné. Les acides aminés avec des groupes R non ionisables sont électriquement neutres à ce pH et forment Zwitterion.
04 Classification
Les AA peuvent être classés en fonction de quatre critères, qui sont décrits ci-dessous à leur tour.
4.1 Selon l'origine
| Selon l'origine, l'AAS peut être divisé en 2 catégories comme suit. ① Catégorie naturelle Certains composés naturels contenant des acides aminés ont également la capacité de réduire la tension en surface / interfaciale, et certains dépassent même l'efficacité des glycolipides. Ces AA sont également appelés lipopeptides. Les lipopeptides sont des composés de faible poids moléculaire, généralement produits par les espèces de Bacillus.
De tels AAS sont encore divisés en 3 sous-classes:Surfactine, iturin et fengycine.
|
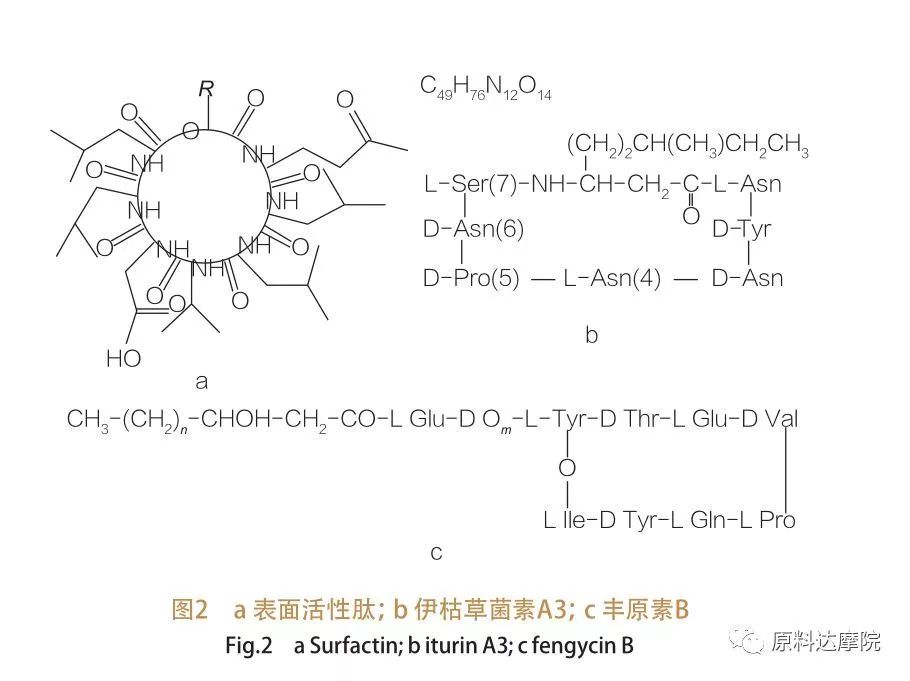
| La famille des peptides actifs en surface englobe les variantes heptapeptidiques d'une variété de substances,Comme le montre la figure 2A, dans laquelle une chaîne gras-hydroxy gras β insaturée C12-C16 est liée au peptide. Le peptide actif en surface est une lactone macrocyclique dans laquelle l'anneau est fermé par catalyse entre l'extrémité C-terminale de l'acide gras β-hydroxy et le peptide. Dans la sous-classe d'Iturin, il existe six variantes principales, à savoir Iturin A et C, Mycosubtilin et Bacillomycine D, F et L.Dans tous les cas, les heptapeptides sont liés aux chaînes C14-C17 des acides gras β-amino (les chaînes peuvent être diverses). Dans le cas des ékurimycines, le groupe amino en position β peut former une liaison amide avec l'extrémité C-terminale formant ainsi une structure de lactame macrocyclique.
La fengycine sous-classe contient la fengycine A et B, qui sont également appelées plipastatine lorsque Tyr9 est configuré en D.Le décapeptide est lié à une chaîne d'acide gras β-hydroxy à β-hydroxy C14 -C18. Structurellement, la plipastatine est également une lactone macrocyclique, contenant une chaîne latérale Tyr en position 3 de la séquence peptidique et formant une liaison ester avec le résidu C-terminal, formant ainsi une structure de cycle interne (comme c'est le cas pour de nombreux lipopeptides de Pseudomonas).
Catégorie de synthèse Les AA peuvent également être synthétisés en utilisant l'un des acides aminés acides, basiques et neutres. Les acides aminés courants utilisés pour la synthèse des AA sont l'acide glutamique, la sérine, la proline, l'acide aspartique, la glycine, l'arginine, l'alanine, la leucine et les hydrolysats de protéines. Cette sous-classe de surfactants peut être préparée par des méthodes chimiques, enzymatiques et chimioenzymatiques; Cependant, pour la production d'AAS, la synthèse chimique est plus réalisable économiquement. Les exemples courants incluent l'acide N-lauroyl-L-glutamique et l'acide N-Palmitoyl-L-glutamique.
|
4.2 basé sur des substituants de chaîne aliphatique
Sur la base des substituants de la chaîne aliphatique, les tensioactifs à base d'acides aminés peuvent être divisés en 2 types.
Selon la position du substituant
| AAS sous-substitué Dans les composés n-substitués, un groupe amino est remplacé par un groupe lipophile ou un groupe carboxyle, entraînant une perte de basicité. L'exemple le plus simple des AA substitués à N est les acides aminés n-acyl, qui sont essentiellement des tensioactifs anioniques. Les AA substitués à N ont une liaison amide attachée entre les parties hydrophobes et hydrophiles. La liaison amide a la capacité de former une liaison hydrogène, ce qui facilite la dégradation de ce tensioactif dans un environnement acide, ce qui le rend biodégradable.
②c-substitué AAS Dans les composés C-substitués, la substitution se produit au niveau du groupe carboxyle (via une liaison amide ou ester). Les composés typiques de C-substitués (par exemple les esters ou les amides) sont essentiellement des surfactants cationiques.
AAS AAS et C-substitués Dans ce type de surfactant, les groupes amino et carboxyle sont la partie hydrophile. Ce type est essentiellement un tensioactif amphotérique. |
4.3 Selon le nombre de queues hydrophobes
Sur la base du nombre de groupes de tête et de queues hydrophobes, l'AAS peut être divisé en quatre groupes. AAS à chaîne droite, Gémeaux (dimère) AAS, type Glycérolipide AAs et Bicephalic AMPhiphile (BOLA) type AAS. Les tensioactifs à chaîne droite sont des tensioactifs constitués d'acides aminés avec une seule queue hydrophobe (figure 3). Les Gemini de type AA ont deux groupes de tête polaire d'acides aminés et deux queues hydrophobes par molécule (figure 4). Dans ce type de structure, les deux AA à chaîne droite sont liés ensemble par une entretoise et sont donc également appelés dimères. Dans le type glycérolipide AAs, en revanche, les deux queues hydrophobes sont fixées au même groupe de tête d'acide aminé. Ces tensioactifs peuvent être considérés comme des analogues des monoglycérides, des diglycérides et des phospholipides, tandis que dans les AA de type Bola, deux groupes de tête d'acide aminé sont liés par une queue hydrophobe.
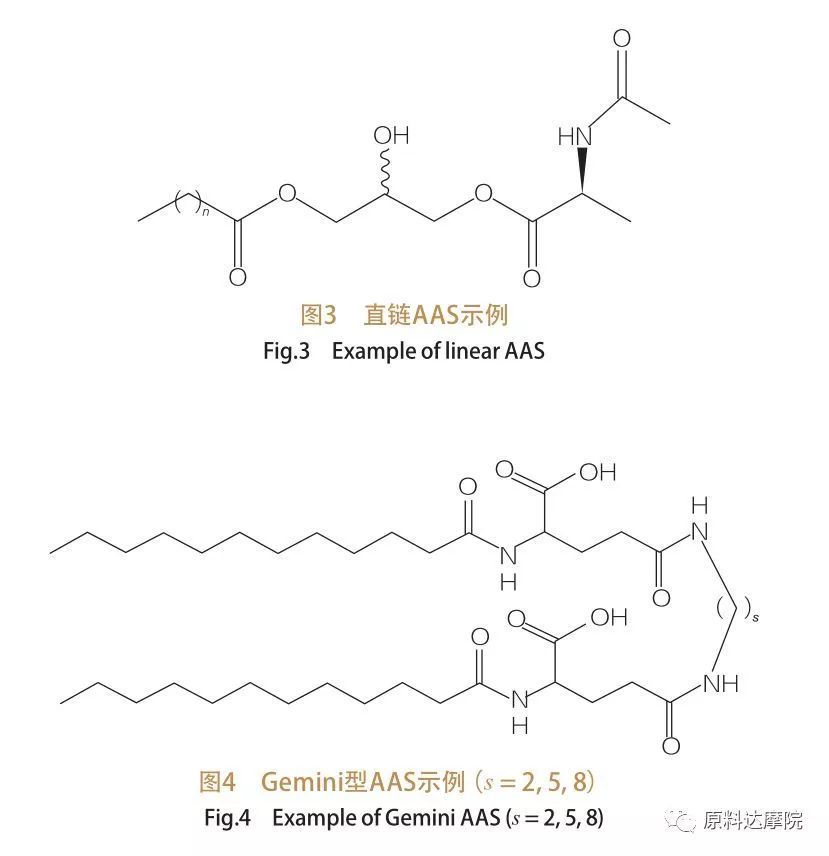
4.4 Selon le type de groupe de tête
①cation AAS
Le groupe de tête de ce type de surfactant a une charge positive. Le premier AAs cationique est l'arginate d'éthyle cocoyl, qui est un carboxylate de pyrrolidone. Les propriétés uniques et diverses de ce tensioactif le rendent utile dans les désinfectants, les agents antimicrobiens, les agents antistatiques, les conditionneurs capillaires, tout en étant doux sur les yeux et la peau et facilement biodégradables. Singare et Mhatre ont synthétisé des AA cationiques à base d'arginine et ont évalué leurs propriétés physicochimiques. Dans cette étude, ils ont réclamé des rendements élevés des produits obtenus en utilisant des conditions de réaction Schotten-Baumann. Avec l'augmentation de la longueur de la chaîne alkyle et de l'hydrophobicité, l'activité de surface du tensioactif s'est avérée augmenter et la concentration critique de micelles (CMC) pour diminuer. Un autre est la protéine acyle quaternaire, qui est couramment utilisée comme conditionneur dans les produits de soins capillaires.
②Anionic AAS
Dans les tensioactifs anioniques, le groupe de tête polaire du tensioactif a une charge négative. La sarcosine (CH 3 -NH-CH 2 -COOH, N-méthylglycine), un acide aminé couramment trouvé dans les oursins et les étoiles de mer, est chimiquement liée à la glycine (NH 2 -CH 2 -COOH,), un acide aminé fondamental trouvé dans les cellules mammifères. -Cooh,) est chimiquement lié à la glycine, qui est un acide aminé de base présent dans les cellules de mammifères. L'acide laurique, l'acide tétradécanoïque, l'acide oléique et leurs halogénures et esters sont couramment utilisés pour synthétiser les tensioactifs sarcosinnés. Les sarcosinates sont intrinsèquement douces et sont donc couramment utilisées dans les bains de bouche, les shampooings, les mousses de rasage par pulvérisation, les écrans solaires, les nettoyants de la peau et d'autres produits cosmétiques.
Les autres AA anioniques disponibles dans le commerce comprennent Amisoft CS-22 et AmilitegCK-12, qui sont des noms commerciaux pour le n-cocoyl-l-glutamate de sodium et le glycinate de No-cocoyle de potassium, respectivement. Amilite est couramment utilisée comme agent moussant, détergent, solubilisation, émulsifiant et dispersant, et possède de nombreuses applications en cosmétiques, telles que les shampooings, les savons de bain, les lavages corporels, les dentifriseurs, les nettoyants pour le visage, les soaps de nettoyage, les nettoyeurs de lentilles de contact et les tensions ménagers. Amisoft est utilisé comme un nettoyant doux pour la peau et les cheveux, principalement dans les nettoyants pour le visage et le corps, les détergents synthétiques, les produits de soins du corps, les shampooings et autres produits de soins de la peau.
③zwitterionic ou AAS amphotériques
Les tensioactifs amphotériques contiennent à la fois des sites acides et de base et peuvent donc modifier leur charge en modifiant la valeur du pH. Dans les milieux alcalins, ils se comportent comme des tensioactifs anioniques, tandis que dans des environnements acides, ils se comportent comme des tensioactifs cationiques et dans des milieux neutres comme des tensioactifs amphotériques. Lauryl lysine (LL) et l'alcoxy (2-hydroxypropyl) arginine sont les seuls tensioactifs amphotériques connus à base d'acides aminés. LL est un produit de condensation de la lysine et de l'acide laurique. En raison de sa structure amphotérique, LL est insoluble dans presque tous les types de solvants, à l'exception des solvants très alcalins ou acides. En tant que poudre organique, LL a une excellente adhérence aux surfaces hydrophiles et un faible coefficient de frottement, ce qui donne à cette excellente capacité de lubrification sur le surfactant. LL est largement utilisé dans les crèmes et les conditionneurs cutanés et est également utilisé comme lubrifiant.
④NONIONIQUE AAS
Les tensioactifs non ioniques sont caractérisés par des groupes de tête polaire sans charges formelles. Huit nouveaux tensioactifs non ioniques éthoxylés ont été préparés par Al-Sabagh et al. à partir des acides α-aminés solubles dans l'huile. Dans ce processus, la L-phénylalanine (LEP) et la L-leucine ont d'abord été estérifiées avec l'hexadécanol, suivie d'une amidation avec de l'acide palmitique pour donner deux amides et deux esters d'acides α-aminés. Les amides et les esters ont ensuite subi des réactions de condensation avec l'oxyde d'éthylène pour préparer trois dérivés de phénylalanine avec différents nombres d'unités de polyoxyéthylène (40, 60 et 100). Ces AA non ioniques se sont avérés avoir une bonne détergence et des propriétés moussantes.
05 Synthèse
5.1 route synthétique de base
Dans les AAS, les groupes hydrophobes peuvent être attachés à des sites d'acide ou d'acide carboxylique, ou à travers les chaînes latérales des acides aminés. Sur la base de cela, quatre voies synthétiques de base sont disponibles, comme le montre la figure 5.
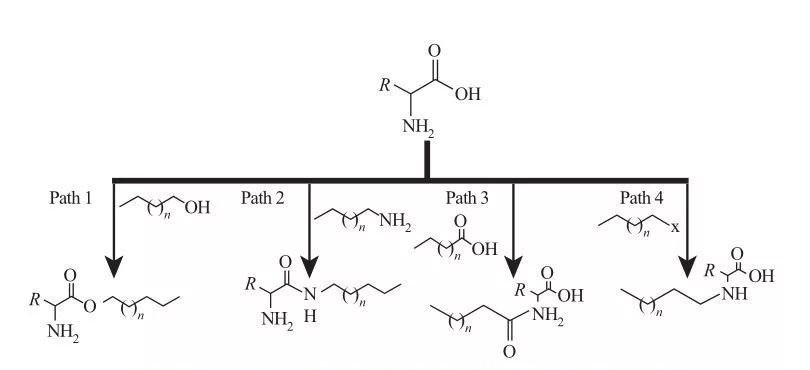
Fig.5 Chemins de synthèse fondamentaux des tensioactifs à base d'acides aminés
| Pathway 1. Les amines d'ester amphiphiles sont produites par des réactions d'estérification, auquel cas la synthèse du surfactant est généralement obtenue par les alcools gras et les acides aminés en présence d'un agent déshydratant et d'un catalyseur acide. Dans certaines réactions, l'acide sulfurique agit à la fois comme un catalyseur et un agent déshydratant.
Pathway 2. Les acides aminés activés réagissent avec les alkylamines pour former des liaisons amide, entraînant la synthèse des amidoamines amphiphiles.
Pathway 3. Les acides amido sont synthétisés en réagissant les groupes aminés d'acides aminés avec des acides amido.
Pathway 4. Les acides aminés alkyle à longue chaîne ont été synthétisés par la réaction des groupes amine avec des haloalcanes. |
5.2 Progrès en synthèse et en production
5.2.1 Synthèse des surfactants d'acides aminés / peptides à chaîne unique
Les acides aminés ou peptides N-acyl ou O-acyl peuvent être synthétisés par acylation catalysée par enzyme des groupes amine ou hydroxyle avec des acides gras. Le premier rapport sur la synthèse catalysée par la lipase sans solvant des dérivés d'acide aminé ou d'ester méthyle a utilisé le candida Antarctique, avec des rendements allant de 25% à 90% selon l'acide aminé cible. Le méthyl éthyl-cétone a également été utilisé comme solvant dans certaines réactions. Vonderhagen et al. A également décrit la lipase et les réactions de N-acylation catalysées par la protéase des acides aminés, des hydrolysats de protéines et / ou de leurs dérivés en utilisant un mélange d'eau et de solvants organiques (par exemple, diméthylformamide / eau) et méthyl-butyl cétone.
Au début, le principal problème avec la synthèse catalysée par les enzymes de l'AAS était les faibles rendements. Selon Valivety et al. Le rendement des dérivés d'acides aminés N-tétradecanoyl n'était que de 2% à 10% même après avoir utilisé différentes lipases et incubé à 70 ° C pendant plusieurs jours. Montet et al. a également rencontré des problèmes concernant le faible rendement des acides aminés dans la synthèse de la n-acyl lysine à l'aide d'acides gras et d'huiles végétales. Selon eux, le rendement maximal du produit était de 19% dans des conditions sans solvant et en utilisant des solvants organiques. Le même problème a été rencontré par Valivety et al. Dans la synthèse des dérivés d'ester méthyle N-CBZ-L-lysine ou N-CBZ-lysine.
Dans cette étude, ils ont affirmé que le rendement de la sérine 3-o-tétradecanoyl-L était de 80% lors de l'utilisation de la sérine protégé par N comme substrat et Nozozyme 435 comme catalyseur dans un environnement sans solvant en fusion. Le nagao et le kito ont étudié l'O-acylation de la l-sérine, de la l-homosérine, de la l-thréonine et de la l-tyrosine (LET) lors de l'utilisation de la lipase les résultats de la réaction (la lipase a été obtenue par Candida cylindracea et Rhizopus Delemar dans le milieu du tampon aqueux) et a signalé que les yields de l'accylation de la l-homosérine et de la L-Sérine étaient quelque peu de lylation de la l-homosérine et de la L-Sérine. de la L-thréonine et laissé s'est produit.
De nombreux chercheurs ont soutenu l'utilisation de substrats peu coûteux et facilement disponibles pour la synthèse d'AAS rentable. Soo et al. affirmé que la préparation des tensioactifs à base d'huile de palme fonctionne mieux avec le lipoenzyme immobilisé. Ils ont noté que le rendement des produits serait meilleur malgré la réaction longue (6 jours). Gerova et al. a étudié la synthèse et l'activité de surface des N-palmitoyle AA chiraux basés sur la méthionine, la proline, la leucine, la thréonine, la phénylalanine et la phénylglycine dans un mélange cyclique / racémique. Pang et Chu ont décrit la synthèse de monomères à base d'acides aminés et de monomères à base d'acide dicarboxylique en solution une série d'esters de polyamide à base d'acides aminés fonctionnels et biodégradables ont été synthétisés par des réactions de co-condensation en solution.
Le cantaeuzène et le guerreiro ont signalé l'estérification des groupes acides carboxyliques de BOC-ALA-OH et BOC-ASP-OH avec des alcools et diols aliphatiques à longue chaîne, avec du dichlorométhane comme solvant et agarose 4B (Sepharose 4B) comme catalyseur. Dans cette étude, la réaction du BOC-ALA-OH avec des alcools gras jusqu'à 16 carbones a donné de bons rendements (51%), tandis que pour les carbones BOC-ASP-OH et 12 étaient meilleurs, avec un rendement correspondant de 63% [64]. 99,9%) dans les rendements allant de 58% à 76%, qui ont été synthétisés par la formation de liaisons amide avec diverses alkylamines à longue chaîne ou des liaisons d'ester avec des alcools gras par CBZ-Arg-Ome, où la papaïne a agi comme catalyseur.
5.2.2 Synthèse des surfactants d'acides aminés / peptides à base de Gémeaux
Les tensioactifs Gémeaux à base d'acides aminés se composent de deux molécules AAS à chaîne droite liées les unes aux autres par un groupe d'espaceurs. Il existe 2 schémas possibles pour la synthèse chimioenzymatique des surfactants à base d'acides aminés de type gemini (figures 6 et 7). Dans la figure 6, 2 dérivés d'acides aminés sont réagis avec le composé en tant que groupe d'espaceurs, puis 2 groupes hydrophobes sont introduits. Dans la figure 7, les 2 structures à chaîne droite sont directement liées entre elles par un groupe d'espaceur bifonctionnel.
Le premier développement de la synthèse catalysée par les enzymes des acides lipoamino-géminis a été lancé par Valivety et al. Yoshimura et al. a étudié la synthèse, l'adsorption et l'agrégation d'un tensioactif gémini à base d'acides aminés basé sur le bromure de cystine et de N-alkyle. Les tensioactifs synthétisés ont été comparés aux tensioactifs monomères correspondants. Faustino et al. Décrit la synthèse des AA monomères monomères à base d'urée anionique basés sur la L-cystine, le d-cystine, le dl-cystine, la l-cystéine, la l-méthionine et la l-sulfoalanine et leurs paires de geminies par conductivité, la tension de surface de l'équilibre et la fluorescence à l'état stable. Il a été démontré que la valeur CMC des Gémeaux était plus faible en comparant le monomère et les gemini.
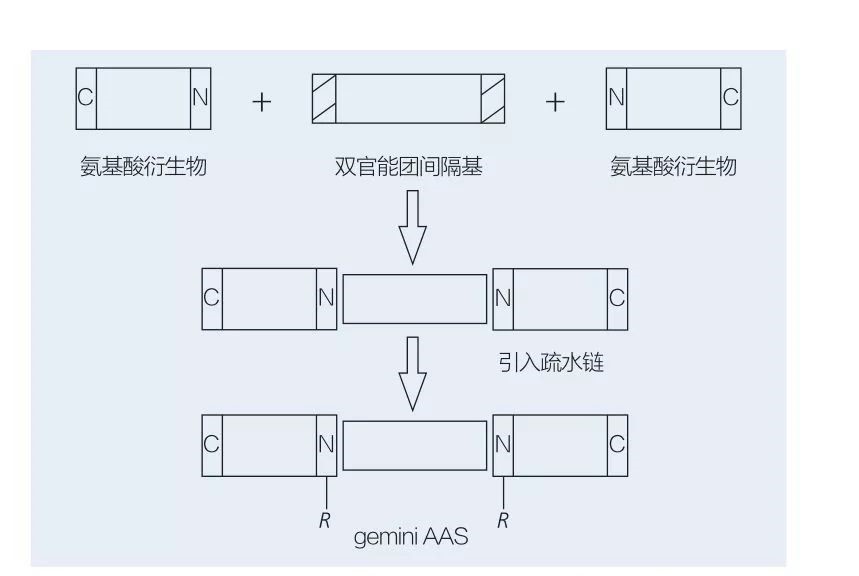
Fig.6 Synthèse des Gémeaux AA à l'aide de dérivés AA et d'espaceur, suivis de l'insertion du groupe hydrophobe
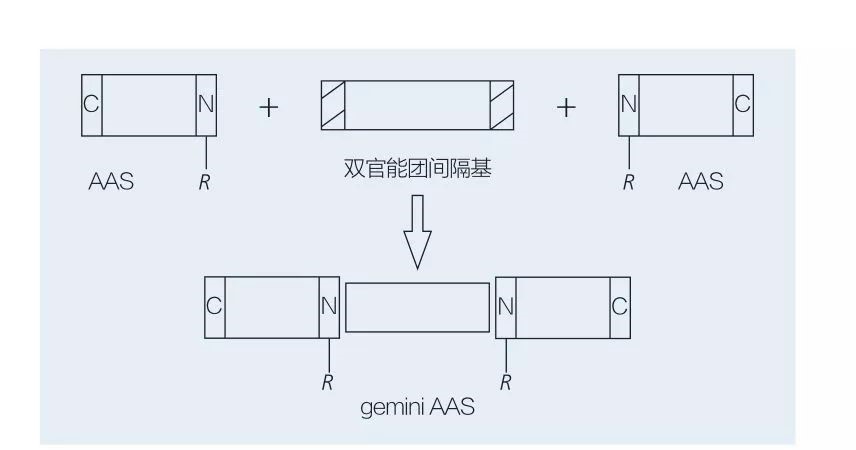
Fig.7 Synthèse des Gémeaux Aass en utilisant une entretoise bifonctionnelle et AAS
5.2.3 Synthèse des acides aminés glycérolipides / peptides tensioactifs
Les tensioactifs de glycérolipide aux acides aminés / peptides sont une nouvelle classe d'acides aminés lipidiques qui sont des analogues structurels de glycérol mono- (ou di-) esters et phospholipides, en raison de leur structure d'une ou deux chaînes grasses avec un acide aminé lié à la recule de glycérol par une liaison d'ester. La synthèse de ces tensioactifs commence par la préparation d'esters de glycérol d'acides aminés à des températures élevées et en présence d'un catalyseur acide (par exemple BF 3). La synthèse catalysée par enzyme (utilisant des hydrolases, protéases et lipases comme catalyseurs) est également une bonne option (figure 8).
La synthèse catalysée par enzyme de conjugués de glycérides d'arginine dilaurylée à l'aide de la papaïne a été signalée. La synthèse des conjugués d'ester diacylglycérol de l'acétylarginine et l'évaluation de leurs propriétés physicochimiques ont également été signalées.
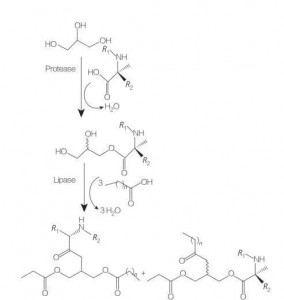
Fig.8 Synthèse des conjugués d'acides aminés mono et diacylglycérol
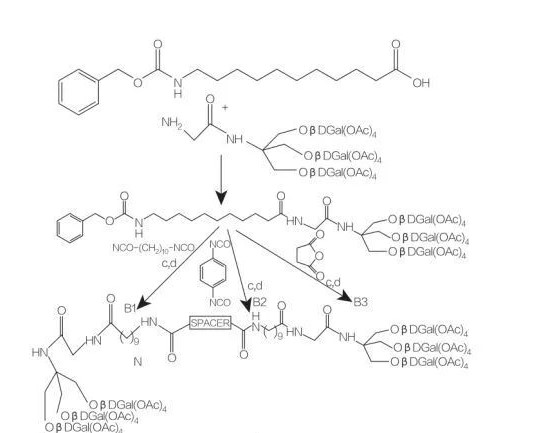
entretoise: nh- (ch2)10-Nh: Compoundb1
entretoise: NH-C6H4-Nh: Compoundb2
entretoise: ch2-Ch2: Compoundb3
Fig.9 Synthèse d'amphiphiles symétriques dérivés de Tris (hydroxyméthyl) aminométhane
5.2.4 Synthèse des surfactants d'acides aminés / peptides à base de Bola
Les amphiphiles de type Bola à base d'acides aminés contiennent 2 acides aminés liés à la même chaîne hydrophobe. Franceschi et al. Décrit la synthèse d'amphiphiles de type Bola avec 2 acides aminés (D ou L-alanine ou L-histidine) et 1 chaîne alkyle de différentes longueurs et étudié leur activité de surface. Ils discutent de la synthèse et de l'agrégation de nouveaux amphiphiles de type Bola avec une fraction d'acide aminé (en utilisant soit un acide β-aminé peu commun ou un alcool) et un groupe d'espaceur C12 -C20. Les acides β-aminés peu communs utilisés peuvent être un aminé de sucre, un acide aminé dérivé de l'azidothymine (AZT), un acide aminé norborborène et un alcool aminé dérivé de l'AZT (figure 9). La synthèse d'amphiphiles symétriques de type Bola dérivés de Tris (hydroxyméthyl) aminométhane (Tris) (figure 9).
06 Propriétés physicochimiques
Il est bien connu que les surfactants à base d'acides aminés (AAS) sont de nature diversifiés et polyvalents et ont une bonne applicabilité dans de nombreuses applications telles que une bonne solubilisation, de bonnes propriétés d'émulsification, une grande efficacité, des performances d'activité de surface élevée et une bonne résistance à l'eau dure (tolérance aux ions calciques).
Sur la base des propriétés du surfactant des acides aminés (par exemple, tension de surface, CMC, comportement de phase et température de Krafft), les conclusions suivantes ont été tirées après des études approfondies - l'activité de surface de l'AAS est supérieure à celle de son homologue de surfactant conventionnel.
6.1 Concentration critique de micelles (CMC)
La concentration critique de micelles est l'un des paramètres importants des tensioactifs et régit de nombreuses propriétés actives de surface telles que la solubilisation, la lyse cellulaire et son interaction avec les biofilms, etc. En général, l'augmentation de la longueur de la chaîne de la queue d'hydrocarbure (augmentant l'hydrophobicité) entraîne une diminution de la valeur CMC de la solution de suffact, ainsi que son activité de surface. Les tensioactifs basés sur les acides aminés ont généralement des valeurs de CMC plus faibles par rapport aux tensioactifs conventionnels.
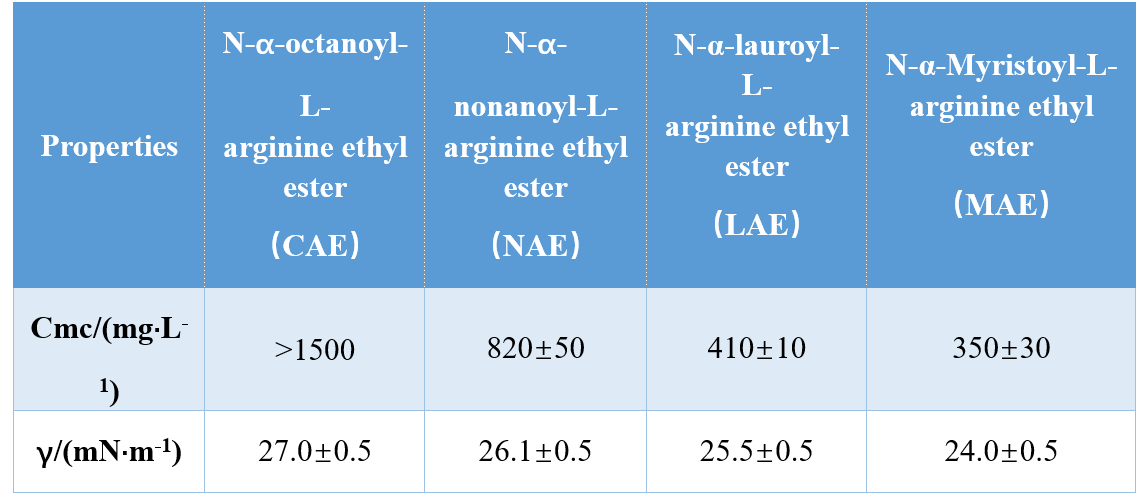
Grâce à différentes combinaisons de groupes de tête et de queues hydrophobes (amide mono-cationique, amide bi-cationique, ester à base d'amide bi-cationique), Infante et al. synthétisé trois AA à base d'arginine et étudié leur CMC et γCMC (tension de surface à CMC), montrant que les valeurs CMC et γCMC ont diminué avec l'augmentation de la longueur de la queue hydrophobe. Dans une autre étude, Singare et Mhatre ont constaté que le CMC des tensioactifs de N-α-acylarginine diminuait avec l'augmentation du nombre d'atomes de carbone de queue hydrophobe (tableau 1).
Yoshimura et al. a étudié le CMC des surfactants des géminites à base d'acides aminés dérivés de la cystéine et a montré que le CMC diminuait lorsque la longueur de la chaîne de carbone dans la chaîne hydrophobe était augmentée de 10 à 12. Augmentation davantage de la longueur de la chaîne de carbone à 14 a entraîné une augmentation de la CMC, ce qui a confirmé que les commentaires géminites à long terme ont augmenté de plus de tendance à des agrégats.
Faustino et al. ont rapporté la formation de micelles mixtes dans des solutions aqueuses de tensioactifs anioniques Gémeaux basés sur la cystine. Les surfactants Gemini ont également été comparés aux tensioactifs monomères conventionnels correspondants (C 8 Cys). Les valeurs CMC des mélanges de surfactations lipidiques étaient inférieures à celles des tensioactifs purs. Les surfactants des Gémeaux et la 1,2-diheptanoyl-SN-glycéryl-3-phosphocholine, un phospholipide soluble dans l'eau, formant des micelles, avaient du CMC au niveau millimolaire.
Shrestha et Aramaki ont étudié la formation de micelles de type ver viscoélastique dans des solutions aqueuses de tensioactifs anioniques-nononiques à base d'acides aminés mixtes en l'absence de sels de mélange. Dans cette étude, le glutamate de N-dodecyle s'est avéré avoir une température de krafft plus élevée; Cependant, lorsqu'il est neutralisé avec la L-lysine de base des acides aminés, il a généré des micelles et la solution a commencé à se comporter comme un liquide newtonien à 25 ° C.
6.2 Bonne solubilité dans l'eau
La bonne solubilité dans l'eau de l'AAS est due à la présence de liaisons Co-NH supplémentaires. Cela rend les AAS plus biodégradables et respectueux de l'environnement que les tensioactifs conventionnels correspondants. La solubilité dans l'eau de l'acide N-acyl-L-glutamique est encore meilleure en raison de ses 2 groupes carboxyle. La solubilité dans l'eau de CN (CA) 2 est également bonne car il existe 2 groupes d'arginine ionique dans 1 molécule, ce qui entraîne une adsorption et une diffusion plus efficaces à l'interface cellulaire et même une inhibition bactérienne efficace à des concentrations plus faibles.
6.3 Température de Krafft et point de krafft
La température de Krafft peut être comprise comme le comportement de solubilité spécifique des tensioactifs dont la solubilité augmente fortement au-dessus d'une température particulière. Les tensioactifs ioniques ont tendance à générer des hydrates solides, qui peuvent précipiter hors de l'eau. À une température particulière (la température dite de Krafft), une augmentation spectaculaire et discontinue de la solubilité des tensioactifs est généralement observée. Le point Krafft d'un tensioactif ionique est sa température Krafft à CMC.
Cette caractéristique de solubilité est généralement observée pour les tensioactifs ioniques et peut être expliquée comme suit: La solubilité du monomère sans surfactant est limitée en dessous de la température de Krafft jusqu'à ce que le point de Krafft soit atteint, où sa solubilité augmente progressivement en raison de la formation de micelles. Pour assurer une solubilité complète, il est nécessaire de préparer des formulations de surfactant à des températures au-dessus du point de Krafft.
La température Krafft des AAS a été étudiée et comparée à celle des tensioactifs synthétiques conventionnels. AAS et a discuté de la relation entre leur température Krafft et les résidus d'acides aminés.
Dans les expériences, il a été constaté que la température de Krafft de N-hexadecanoyl AAs augmentait avec une taille décroissante des résidus d'acides aminés (la phénylalanine étant une exception), tandis que la chaleur de la solubilité (absorption de chaleur) a augmenté avec une taille diminuée des résidus d'acides aminés (à l'exception de la glycine et de la phénylalanine). Il a été conclu que dans les systèmes d'alanine et de phénylalanine, l'interaction DL est plus forte que l'interaction LL dans la forme solide du sel N-hexadécanoyl AAS.
Brito et al. a déterminé la température de Krafft de trois séries de nouveaux tensioactifs à base d'acides aminés en utilisant la microcalorimétrie à balayage différentiel et a constaté que le changement de l'ion trifluoroacétate en ion iodure a entraîné une augmentation significative de la température de Krafft (environ 6 ° C), de 47 ° C à 53 ° C. La présence de liaisons cis-doubles et l'insaturation présente dans les dérivés Ser-dérivés à longue chaîne ont entraîné une diminution significative de la température de Krafft. Le glutamate de N-dodecyle aurait une température de krafft plus élevée. Cependant, la neutralisation avec la L-lysine de base des acides aminés a entraîné la formation de micelles en solution qui se comportaient comme des fluides newtoniens à 25 ° C.
6.4 Tension de surface
La tension superficielle des tensioactifs est liée à la longueur de la chaîne de la partie hydrophobe. Zhang et al. a déterminé la tension en surface du glycinate de cocoyl de sodium par la méthode de la plaque de Wilhelmy (25 ± 0,2) ° C et a déterminé la valeur de tension de surface à CMC à 33 mn-m -1, CMC à 0,21 mmol-L -1. Yoshimura et al. a déterminé la tension de surface de la tension de surface de surface à base d'acides aminés de type 2C de type 2C des agents actifs de surface basés sur 2C N Cys. Il a été constaté que la tension de surface à CMC diminuait avec l'augmentation de la longueur de la chaîne (jusqu'à n = 8), tandis que la tendance a été inversée pour les tensioactifs avec n = 12 ou plus de longueurs de chaîne.
L'effet de CAC1 2 sur la tension en surface des tensioactifs à base d'acides aminés dicarboxylés a également été étudié. In these studies, CaC1 2 was added to aqueous solutions of three dicarboxylated amino acid-type surfactants (C12 MalNa 2, C12 AspNa 2, and C12 GluNa 2). Les valeurs du plateau après CMC ont été comparées et il a été constaté que la tension de surface diminuait à de très faibles concentrations de CAC1 2. Cela est dû à l'effet des ions calcium sur la disposition du tensioactif à l'interface gaz-gaz. the surface tensions of the salts of N-dodecylaminomalonate and N-dodecylaspartate, on the other hand, were also almost constant up to 10 mmol-L -1 CaC1 2 concentration. Au-dessus de 10 mmol-L -1, la tension de surface augmente fortement, en raison de la formation d'une précipitation du sel de calcium du tensioactif. For the disodium salt of N-dodecyl glutamate, moderate addition of CaC1 2 resulted in a significant decrease in surface tension, while continued increase in CaC1 2 concentration no longer caused significant changes.
Pour déterminer la cinétique d'adsorption des AA de type gemini à l'interface gaz-eau, la tension de surface dynamique a été déterminée en utilisant la méthode de pression de bulle maximale. Les résultats ont montré que pour le temps de test le plus long, la tension de surface dynamique 2C 12 Cys n'a pas changé. La diminution de la tension de surface dynamique dépend uniquement de la concentration, de la longueur des queues hydrophobes et du nombre de queues hydrophobes. Une concentration croissante de surfactant, une diminution de la longueur de la chaîne ainsi que le nombre de chaînes ont entraîné une décroissance plus rapide. Les résultats obtenus pour des concentrations plus élevées de C n Cys (n = 8 à 12) se sont révélés très proches du γ CMC mesuré par la méthode Wilhelmy.
Dans une autre étude, les tensions de surface dynamiques de la cystine de sodium dilauryle (SDLC) et de la cystine de dicécamino sodium ont été déterminées par la méthode de la plaque Wilhelmy, et en outre, les tensions de surface d'équilibre de leurs solutions aqueuses ont été déterminées par la méthode du volume de goutte. La réaction des liaisons disulfure a également été étudiée par d'autres méthodes. L'ajout de mercaptoéthanol à 0,1 mmol-L -1SDLC a conduit à une augmentation rapide de la tension en surface de 34 mn-m -1 à 53 mn-m -1. Étant donné que NaClo peut oxyder les liaisons disulfure de SDLC en groupes d'acide sulfonique, aucun agrégat n'a été observé lorsque NaClo (5 mmol-L -1) n'a été ajouté à la solution SDLC de 0,1 mmol-L -1. Les résultats de la microscopie électronique à transmission et de la diffusion dynamique de la lumière ont montré qu'aucun agrégat n'était formé dans la solution. La tension en surface du SDLC s'est avérée passer de 34 mn-m -1 à 60 mn-m -1 sur une période de 20 min.
6.5 Interactions de surface binaire
Dans les sciences de la vie, un certain nombre de groupes ont étudié les propriétés vibrationnelles des mélanges d'AaS cationiques (tensioactifs à base d'arginine diacylglycérol) et des phospholipides à l'interface gaz-gaz, concluant finalement que cette propriété non idéale provoque la prévalence des interactions électrostatiques.
6.6 Propriétés d'agrégation
La diffusion dynamique de la lumière est couramment utilisée pour déterminer les propriétés d'agrégation des monomères à base d'acides aminés et des tensioactifs gemini à des concentrations supérieures au CMC, donnant un diamètre hydrodynamique apparent DH (= 2R H). Les agrégats formés par C n Cys et 2CN Cys sont relativement grands et ont une distribution à grande échelle par rapport aux autres tensioactifs. Tous les tensioactifs sauf 2C 12 Cys forment généralement des agrégats d'environ 10 nm. Les tailles de micelles des surfactants Gemini sont significativement plus grandes que celles de leurs homologues monomères. Une augmentation de la longueur de la chaîne d'hydrocarbures entraîne également une augmentation de la taille des micelles. Ohta et al. décrit les propriétés d'agrégation de trois stéréoisomères différents du N-dodecyl-phényl-alanyl-phényl-alanine tétraméthylammonium en solution aqueuse et ont montré que les diastéréoisomères ont la même concentration d'agrégation critique en solution aqueuse. Iwahashi et al. étudié par dichroïsme circulaire, RMN et osmométrie de pression de vapeur La formation d'agrégats chiraux de N-Dodecanoyl-L-glutamique, N-Dodecanoyl-L-Valine et leurs esters méthyliques dans différents solvants (tels que la tétrahydrofure, l'acétonitrile, la properte de 1,4 et la properte de dioxane et le 1,2-dichloro-étravé Dichroïsme circulaire, RMN et osmométrie de pression de vapeur.
6.7 Adsorption interfaciale
L'adsorption interfaciale des tensioactifs à base d'acides aminés et sa comparaison avec son homologue conventionnel sont également l'une des directions de recherche. Par exemple, les propriétés d'adsorption interfaciales des esters de dodécyle des acides aminés aromatiques obtenus à partir de LET et LEP ont été étudiés. Les résultats ont montré que let et lep présentaient des zones interfaciales plus faibles à l'interface gaz-liquide et à l'interface de l'eau / hexane, respectivement.
Bordes et al. a étudié le comportement de la solution et l'adsorption à l'interface gaz-gaz de trois tensioactifs en acides aminés dicarboxylés, les sels de dostodium du dodécyl glutamate, le dodécyl aspartate et l'aminomalonate (avec 3, 2 et 1 atomes de carbone entre les deux groupes carboxyle, respectivement). Selon ce rapport, le CMC des tensioactifs dicarboxylés était 4 à 5 fois plus élevé que celui du sel de dodécyl glycine monocarboxylé. Ceci est attribué à la formation de liaisons hydrogène entre les tensioactifs dicarboxylés et les molécules voisines à travers les groupes amides qui s'y trouvent.
6,8 comportement de phase
Des phases cubiques discontinues isotropes sont observées pour les tensioactifs à des concentrations très élevées. Les molécules de surfactant avec de très grands groupes de tête ont tendance à former des agrégats de courbure positive plus petite. Marques et al. studied the phase behavior of the 12Lys12/12Ser and 8Lys8/16Ser systems (see Figure 10), and the results showed that the 12Lys12/12Ser system has a phase separation zone between the micellar and vesicular solution regions, while the 8Lys8/16Ser system The 8Lys8/16Ser system shows a continuous transition (elongated micellar phase region between the small micellar phase region and the vesicle phase région). Il convient de noter que pour la région des vésicules du système 12LYS12 / 12SER, les vésicules coexistent toujours avec les micelles, tandis que la région vésicale du système 8lys8 / 16ser n'a que des vésicules.
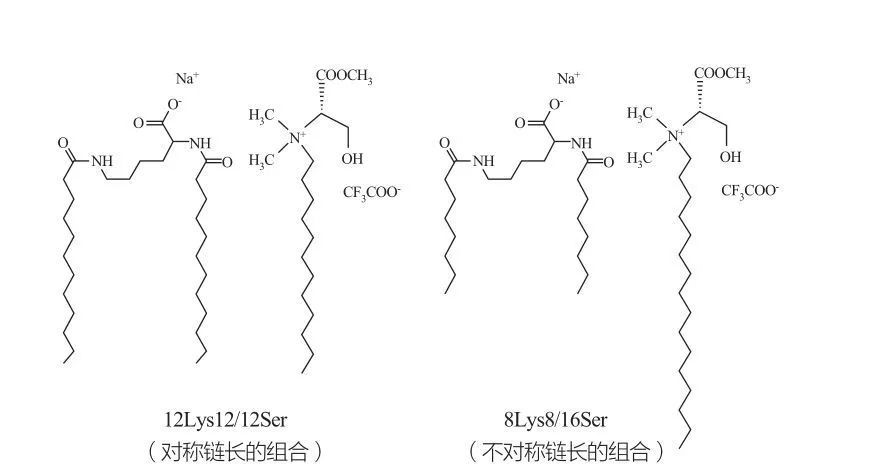
Mélanges catanioniques des tensioactifs à base de lysine et sérine: paire symétrique 12lys12 / 12ser (à gauche) et paire asymétrique 8lys8 / 16ser (à droite)
6.9 Capacité émulsifiante
Kouchi et al. a examiné la capacité émulsifiante, la tension interfaciale, la dispersibilité et la viscosité de la n- [3-dodecyl-2-hydroxypropyl] -l-arginine, du l-glutamate et d'autres AA. En comparaison avec les tensioactifs synthétiques (leurs homologues conventionnels non ioniques et amphotériques), les résultats ont montré que les AA ont une capacité émulsifiante plus forte que les tensioactifs conventionnels.
Baczko et al. synthétisé de nouveaux tensioactifs en acides aminés anioniques et étudié leur aptitude en tant que solvants de spectroscopie RMN orientés chiraux. Une série de dérivés amphiphiles de l-PHE ou de L-ALA à base de sulfonate avec différentes queues hydrophobes (pentyl ~ tétradecyl) a été synthétisée en réagissant aux acides aminés avec de l'anhydride O-sulfobenzoïque. Wu et al. Salts de sodium synthétiséont étudié leur capacité d'émulsification dans les émulsions huile-dans-eau, et les résultats ont montré que ces tensioactifs fonctionnaient mieux avec l'acétate d'éthyle comme phase huileuse qu'avec le n-hexane comme phase huileuse.
6.10 progrès de la synthèse et de la production
La résistance à l'eau dure peut être comprise comme la capacité des tensioactifs à résister à la présence d'ions tels que le calcium et le magnésium dans l'eau dure, c'est-à-dire la capacité d'éviter les précipitations dans les savons de calcium. Les tensioactifs à forte résistance à l'eau dure sont très utiles pour les formulations de détergents et les produits de soins personnels. La résistance à l'eau dure peut être évaluée en calculant le changement de solubilité et d'activité de surface du tensioactif en présence d'ions calcium.
Une autre façon d'évaluer la résistance à l'eau dure consiste à calculer le pourcentage ou les grammes de surfactant requis pour le savon de calcium formé à partir de 100 g d'oliate de sodium à disperser dans l'eau. Dans les zones à eau dure élevée, des concentrations élevées d'ions de calcium et de magnésium et de teneur en minéraux peuvent rendre certaines applications pratiques difficiles. Souvent, l'ion sodium est utilisé comme contre-ion d'un tensioactif anionique synthétique. Étant donné que l'ion calcium divalent est lié aux deux molécules de surfactant, elle rend le surfactant à précipiter plus facilement à partir de la détermination de la détermination à la solution.
L'étude de la résistance à l'eau dure des AAS a montré que la résistance à l'acide et à l'eau dure était fortement influencée par un groupe carboxyle supplémentaire, et la résistance à l'acide et à l'eau dure a augmenté davantage avec l'augmentation de la longueur du groupe d'espaceur entre les deux groupes carboxyle. L'ordre d'acide et de résistance à l'eau dure était c 12 glycinate <c 12 aspartate <c 12 glutamate. En comparant la liaison amide dicarboxylée et le tensioactif aminé dicarboxylé, respectivement, il a été constaté que la plage de pH de ce dernier était plus large et que son activité de surface augmentait avec l'ajout d'une quantité appropriée d'acide. Les acides aminés N-alkyle dicarboxylés ont montré un effet chélatant en présence d'ions calcium, et C 12 a formé du gel blanc. C 12 glutamate a montré une activité de surface élevée à une concentration élevée de Ca 2+ et devrait être utilisé dans le dessalement de l'eau de mer.
6.11 Dispersibilité
La dispersibilité fait référence à la capacité d'un tensioactif à prévenir la coalescence et la sédimentation du tensioactif en solution.La dispersibilité est une propriété importante des tensioactifs qui les rend adaptés à une utilisation dans les détergents, les cosmétiques et les produits pharmaceutiques.Un agent de dispersion doit contenir une liaison ester, éther, amide ou aminé entre le groupe hydrophobe et le groupe hydrophile terminal (ou parmi les groupes hydrophobes de la chaîne droite).
Généralement, les tensioactifs anioniques tels que les sulfates d'alcanolamido et les tensioactifs amphotériques tels que l'amidosulfobétaïne sont particulièrement efficaces en tant qu'agents de dispersion des savons de calcium.
De nombreux efforts de recherche ont déterminé la dispersibilité de l'AAS, où la n-lauroyl lysine s'est avérée mal compatible avec l'eau et difficile à utiliser pour les formulations cosmétiques.Dans cette série, les acides aminés de base substitués au n-acyl ont une superbe dispersibilité et sont utilisés dans l'industrie cosmétique pour améliorer les formulations.
07 Toxicité
Les tensioactifs conventionnels, en particulier les tensioactifs cationiques, sont très toxiques pour les organismes aquatiques. Leur toxicité aiguë est due au phénomène de l'interaction d'adsorption-ion des tensioactifs à l'interface cellule-eau. La diminution du CMC des tensioactifs conduit généralement à une adsorption interfaciale plus forte des tensioactifs, ce qui entraîne généralement leur toxicité aiguë élevée. Une augmentation de la durée de la chaîne hydrophobe de surfactants entraîne également une augmentation de la toxicité aiguë du surfactant.La plupart des AA sont faibles ou non toxiques pour l'homme et l'environnement (en particulier pour les organismes marins) et conviennent à une utilisation comme ingrédients alimentaires, pharmaceutiques et cosmétiques.De nombreux chercheurs ont démontré que les tensioactifs en acides aminés sont doux et non irritants pour la peau. Les tensioactifs à base d'arginine sont connus pour être moins toxiques que leurs homologues conventionnels.
Brito et al. a étudié les propriétés physicochimiques et toxicologiques des amphiphiles à base d'acides aminés et leurs [dérivés de la tyrosine (Tyr), de l'hydroxyproline (HYP), de la sérine (SER) et de la lysine (Lys)] Formation spontanée des vésicules cationiques et ont donné des données sur leur toxicité aiguë à la daphnie magna (IC 50). Ils ont synthétisé des vésicules cationiques du bromure de bromure de dodécyltriméthylammonium (DTAB) / lys-dérivés et / ou des mélanges dérivés de ser- / lys et ont testé leur écotoxicité et leur potentiel hémolytique, montrant que tous les AAS et leurs mélanges contenant des vésicules étaient moins toxiques que le DTAB infactant conventionnel.
Rosa et al. a étudié la liaison (association) de l'ADN à des vésicules cationiques à base d'acides aminés stables. Contrairement aux tensioactifs cationiques conventionnels, qui semblent souvent toxiques, l'interaction des surfactants d'acides aminés cationiques semble être non toxique. L'AAS cationique est basé sur l'arginine, qui forme spontanément des vésicules stables en combinaison avec certains tensioactifs anioniques. Les inhibiteurs de corrosion à base d'acides aminés seraient également non toxiques. Ces tensioactifs sont facilement synthétisés avec une pureté élevée (jusqu'à 99%), à faible coût, facilement biodégradable et complètement soluble dans les milieux aqueux. Plusieurs études ont montré que les surfactants d'acides aminés contenant du soufre sont supérieurs dans l'inhibition de la corrosion.
Dans une étude récente, Peinelli et al. ont rapporté un profil toxicologique satisfaisant des rhamnolipides par rapport aux tensioactifs conventionnels. Les rhamnolipides sont connus pour agir comme des améliorateurs de perméabilité. Ils ont également signalé l'effet des rhamnolipides sur la perméabilité épithéliale des médicaments macromoléculaires.
08 Activité antimicrobienne
L'activité antimicrobienne des tensioactifs peut être évaluée par la concentration minimale inhibitrice. L'activité antimicrobienne des tensioactifs à base d'arginine a été étudiée en détail. Les bactéries à Gram négatif se sont révélées plus résistantes aux tensioactifs à base d'arginine que les bactéries gram-positives. L'activité antimicrobienne des tensioactifs est généralement augmentée par la présence de liaisons hydroxyle, cyclopropane ou insaturées dans les chaînes acyle. Castillo et al. ont montré que la longueur des chaînes acyle et la charge positive déterminent la valeur HLB (équilibre hydrophile-lipophile) de la molécule, et celles-ci ont un effet sur leur capacité à perturber les membranes. L'ester méthylique Nα-acylarginine est une autre classe importante de tensioactifs cationiques avec une activité antimicrobienne à large spectre et il est facilement biodégradable et a une toxicité faible ou pas. Studies on the interaction of Nα-acylarginine methyl ester-based surfactants with 1,2-dipalmitoyl-sn-propyltrioxyl-3-phosphorylcholine and 1,2-ditetradecanoyl-sn-propyltrioxyl-3-phosphorylcholine, model membranes, and with living organisms in the presence or absence of external barriers have shown that this class of surfactants has good Antimicrobiens Les résultats ont montré que les tensioactifs ont une bonne activité antibactérienne.
09 Propriétés rhéologiques
Les propriétés rhéologiques des tensioactifs jouent un rôle très important dans la détermination et la prévision de leurs applications dans différentes industries, notamment la nourriture, les produits pharmaceutiques, l'extraction d'huile, les soins personnels et les produits de soins à domicile. De nombreuses études ont été menées pour discuter de la relation entre la viscoélasticité des surfactants d'acides aminés et le CMC.
10 applications dans l'industrie cosmétique
Les AA sont utilisés dans la formulation de nombreux produits de soins personnels.Le glycinate de Notassium N-COCOYL se révèle être doux sur la peau et est utilisé dans le nettoyage du visage pour éliminer les boues et le maquillage. L'acide n-acyl-l-glutamique a deux groupes carboxyle, ce qui le rend plus soluble dans l'eau. Parmi ces AAS, les AA basés sur les acides gras C 12 sont largement utilisés dans le nettoyage du visage pour éliminer les boues et le maquillage. Les AA avec une chaîne C 18 sont utilisés comme émulsifiants dans les produits de soins de la peau, et les sels d'alanine N-Lauryl sont connus pour créer des mousses crémeuses qui ne sont pas irritantes pour la peau et peuvent donc être utilisées dans la formulation de produits de soins pour bébés. Les AA à base de N-Lauryl utilisés dans le dentifrice ont une bonne détergence similaire au savon et à une forte efficacité inhibitante enzymatique.
Au cours des dernières décennies, le choix des tensioactifs pour les cosmétiques, les produits de soins personnels et les produits pharmaceutiques s'est concentré sur la faible toxicité, la douceur, la douceur du toucher et de la sécurité. Les consommateurs de ces produits sont parfaitement conscients de l'irritation, de la toxicité et des facteurs environnementaux potentiels.
Aujourd'hui, les AAS sont utilisés pour formuler de nombreux shampooings, colorants capillaires et savons de bain en raison de leurs nombreux avantages par rapport à leurs homologues traditionnels en cosmétiques et produits de soins personnels.Les tensioactifs à base de protéines ont des propriétés souhaitables nécessaires aux produits de soins personnels. Certains AAS ont des capacités de formation de films, tandis que d'autres ont de bonnes capacités de moussage.
Les acides aminés sont importants des facteurs hydratants naturels dans la strate corneum. Lorsque les cellules épidermiques meurent, elles font partie de la strate cornée et les protéines intracellulaires sont progressivement dégradées en acides aminés. Ces acides aminés sont ensuite transportés plus loin dans la strate corneum, où ils absorbent les graisses ou les substances en forme de graisse dans la strate épidermique, améliorant ainsi l'élasticité de la surface de la peau. Environ 50% du facteur hydratant naturel de la peau est composé d'acides aminés et de pyrrolidone.
Le collagène, un ingrédient cosmétique commun, contient également des acides aminés qui gardent la peau douce.Des problèmes de peau tels que la rugosité et la matité sont dus en grande partie à un manque d'acides aminés. Une étude a montré que le mélange d'un acide aminé avec une onguent soulagée des brûlures cutanées et que les zones affectées sont retournées à leur état normal sans devenir cicatrices chéloïdes.
Les acides aminés se sont également révélés très utiles pour prendre soin des cuticules endommagées.Les cheveux secs et sans forme peuvent indiquer une diminution de la concentration des acides aminés dans une strate cornée gravement endommagée. Les acides aminés ont la capacité de pénétrer la cuticule dans l'arbre des cheveux et d'absorber l'humidité de la peau.Cette capacité des tensioactifs à base d'acides aminés les rend très utiles dans les shampooings, les colorants, les adoucisseurs de cheveux, les conditionneurs de cheveux et la présence d'acides aminés rend les cheveux forts.
11 applications dans les cosmétiques de tous les jours
Actuellement, il existe une demande croissante de formulations de détergents à base d'acides aminés dans le monde.Les AA sont connus pour avoir une meilleure capacité de nettoyage, une capacité de moussage et des propriétés de ramollissement en tissu, ce qui les rend adaptés aux détergents domestiques, aux shampooings, aux lavages corporels et autres applications.Un AAS amphotérique dérivé de l'acide aspartique serait un détergent très efficace aux propriétés chélateurs. L'utilisation d'ingrédients détergents constitués d'acides N-alkyl-β-aminoéthoxy s'est avérée réduire l'irritation cutanée. A liquid detergent formulation consisting of N-cocoyl-β-aminopropionate has been reported to be an effective detergent for oil stains on metal surfaces. An aminocarboxylic acid surfactant, C 14 CHOHCH 2 NHCH 2 COONa, has also been shown to have better detergency and is used for cleaning textiles, carpets, hair, glass, etc. The 2-hydroxy-3-aminopropionic acid-N,N-acetoacetic acid derivative is known to have good complexing ability and thus gives stability to bleaching agents.
La préparation de formulations détergentes basées sur la N- (N'-Long-Chain Acyl-β-alanyl) -β-alanine a été signalée par Keigo et Tatsuya dans leur brevet pour une meilleure capacité de lavage et une stabilité, une rupture facile de mousse et un bon ramollissement. Kao a développé une formulation détergente basée sur le n-acyl-1 -N-hydroxy-β-alanine et a signalé une faible irritation cutanée, une forte résistance à l'eau et une puissance élevée en élimination des taches.
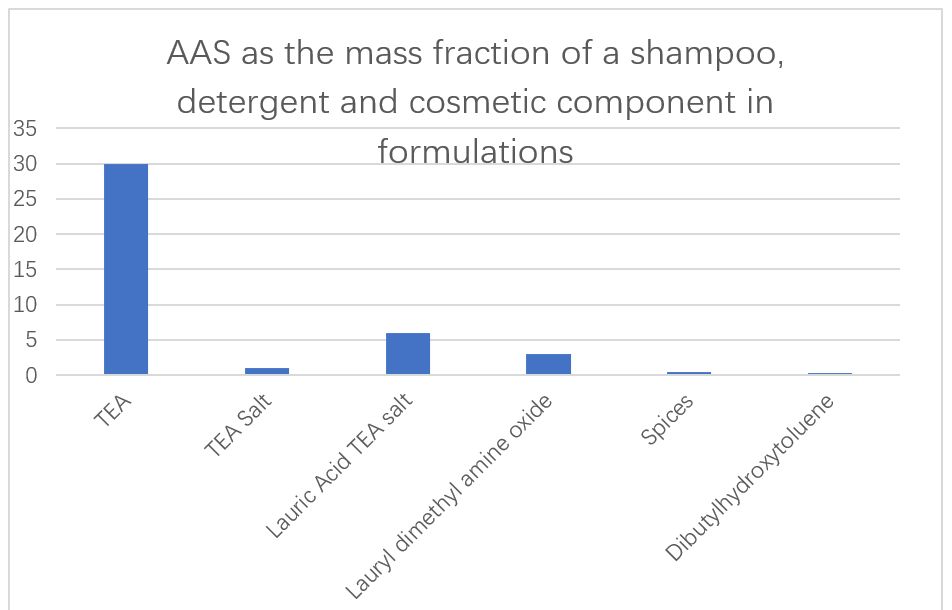
La société japonaise Ajinomoto utilise des AA à faibles toxiques et facilement dégradables basés sur l'acide L-glutamique, la L-arginine et la l-lysine comme principaux ingrédients des shampooings, détergents et cosmétiques (figure 13). La capacité des additifs enzymatiques dans les formulations de détergent à éliminer l'encrassement des protéines a également été signalée. Le N-acyl AAS dérivé d'acide glutamique, d'alanine, de méthylglycine, de sérine et d'acide aspartique a été signalé pour leur utilisation comme d'excellents détergents liquides dans des solutions aqueuses. Ces tensioactifs n'augmentent pas du tout la viscosité, même à des températures très basses, et peuvent être facilement transférés du récipient de stockage du dispositif moussant pour obtenir des mousses homogènes.
Heure du poste: juin-09-2022

